某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol/L NaOH溶液
(1)若实验中大约要使用250 mL NaOH溶液,至少需要称量NaOH固体__________g。
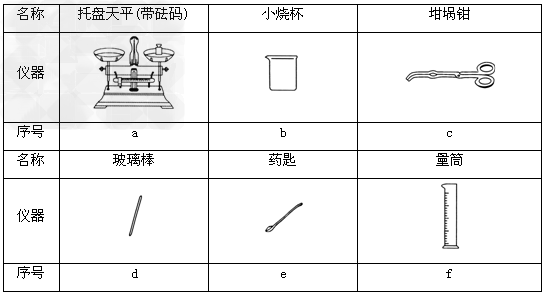
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母):__________。
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
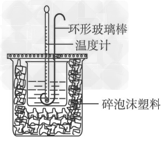
(3)某同学进行该实验时未找到环形玻璃棒,实验中他用铜丝代替环形玻璃棒进行搅拌,请说明此做法的缺点:___________________
(4)写出该反应的热化学方程式(中和热为57.3kJ·mol-1)_______________________
(5)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
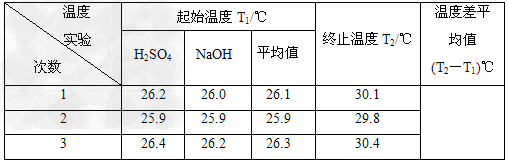
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容C=4.18J/(g·℃)。则中和热ΔH=__________(取小数点后一位)。
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)__________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(1)5.0
(2)a、b、e
(3)用铜丝代替环形玻璃搅拌棒导致热量损失
(4)1/2H2SO4(aq)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l);ΔH=-57.3kJ·mol-1
(5)①4.0;②-53.5 kJ·mol-1;③a、c、d
