科学家研究利用海水处理、回收废气中二氧化硫,其流程如下(序号表示化学反应):
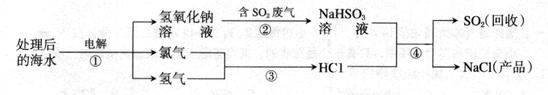 (1) 写出反应①的化学方程式 。
(1) 写出反应①的化学方程式 。
(2) SO2和CO2的化学性质相似。用氢氧化钠溶液吸收SO2时除生成NaHSO3外还可能生成
(写化学式)。
(3) 反应④中发生反应的离子是 。
(4)现有含二氧化硫的废气a g,经过氢氧化钠溶液充分吸收后得到亚硫酸氢钠,消耗氢氧化钠b g,通过计算求二氧化硫在废气中百分含量。
(1)2NaCl+2H2O  2NaOH+Cl2↑+H2↑,
2NaOH+Cl2↑+H2↑,
(2) Na2SO3
(3) HSO3-和H+
(4)1.6b/ a ×100℅
题目分析:(1)根据题意可知,处理后的海水中主要含有氯化钠和水,故①中的反应物是氯化钠和水,结合图示可知生成物是氢气、氯气和氢氧化钠,故该反应的化学方程式为2NaCl+2H2O 2NaOH+Cl2↑+H2↑。
2NaOH+Cl2↑+H2↑。
(2)根据题意,SO2和CO2的化学性质相似,故用氢氧化钠溶液吸收SO2时除生成NaHSO3外还可能生成Na2SO3,因为CO2能与NaOH溶液反应生成Na2CO3,则SO2也能与NaOH反应生成Na2SO3。
(3)根据图示可知,反应④是NaHSO3和HCl反应生成SO2、H2O和NaCl的过程,故该反应的化学方程式为NaHSO3+HCl═NaCl+H2O+SO2↑,由此可知,该反应中发生反应的离子是HSO3-和H+。
(4)根据题意,书写反应的化学方程式,利用消耗的氢氧化钠的质量,可求出参加反应的SO2的质量,进而求出二氧化硫在废气中的百分含量。
解,设废气中含二氧化硫xg
SO2 + NaOH = NaHSO3
64 40
x bg
64:40=x:bg
解得x=1.6bg
则二氧化硫在废气中的百分含量=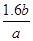 ×100℅
×100℅
答:二氧化硫在废气中的百分含量为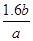 ×100℅。
×100℅。
点评:明确图示中物质的转化关系,熟练掌握相关物质的性质,并能灵活迁移应用,是解答本题的关键;对于方程式的计算,能依据已知量对未知的应求量进行求解计算即可,注意要有完整的计算步骤和规范的书写格式。
