为了测定硫酸铵和氯化铵混合物中氯化铵的质量分数,甲、乙两位同学按下列实验步骤进行实验:称量样品→溶解→加过量试剂A→过滤出现沉淀B→洗涤沉淀→烘干称量→处理实验数据并得出结果。
(1)实验时,甲同学选用硝酸银溶液作试剂A,乙同学选用氯化钡溶液作试剂A,其中同学所选的试剂A不合理,理由是________________。
(2)以下都是在试剂A选择正确时进行的实验:
①为进行称量、溶解、反应、过滤、洗涤沉淀的各项操作,准备了以下仪器:托盘天平与砝码,烧杯、过滤器、铁架台及附件,胶头滴管、量筒,其中还缺少一件必备的仪器是_____________。
②若过滤所得沉淀未经洗涤烘干称量,测得结果将________(填“偏高”或“偏低”)。
③若实验测得混合物的质量为W g,沉淀物的质量为m g,实验测定的氯化铵质量分数计算式=_____________。
(1)甲因为AgNO3既可以与NH4Cl反应生成AgCl白色沉淀,又可与(NH4)2SO4反应生成微溶于水的Ag2SO4,达不到实验目的
(2)①玻璃棒 ②偏低
③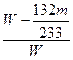 ×100%
×100%
(1)甲同学选用试剂A是错的,因为AgNO3既可以与NH4Cl反应生成AgCl白色沉淀,又可与(NH4)2SO4反应生成微溶于水的Ag2SO4,达不到实验目的。
(2)①玻璃棒,溶解、洗涤、过滤等各步均需使用玻璃棒。
②未经洗涤、烘干就称量,使得称量数值比实际数值大,造成求出的NH4Cl质量分数偏低。
③(NH4)2SO4+BaCl2====BaSO4↓+2NH4Cl
132 233
x m g
x=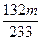 g
g
w(NH4Cl)=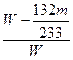 ×100%
×100%