问题
计算题
向盛有400 mL某浓度稀HNO3的大烧杯中加入W g铁粉(还原产物以NO计),充分反应后,铁粉质量减少16.8 g,再往烧杯中加入V mL 4.0 mol·L-1的稀H2SO4,充分反应后,铁粉质量又减少8.4 g,此时铁粉仍有剩余。求:
(1)稀HNO3的物质的量浓度。
(2)V的值。
(3)要使反应中有H2生成,W的取值范围__________。
答案
(1)2.0 mol-1·L-1(2)50 mL
(3)W>67.2 g
(1)
3Fe + 8HNO3====3Fe(NO3)2+2NO↑+4H2O
3 8
 n1
n1
n1(HNO3)="0.8" mol
c(HNO3)=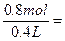 2. 0 mol·L-1
2. 0 mol·L-1
(2)3Fe + 8H++2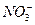 ="===" 3Fe2++2NO↑+4H2O
="===" 3Fe2++2NO↑+4H2O
3 8
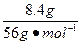 n2
n2
n2(H+)="0.4" mol
需V(H2SO4)=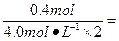 0.05 L,即50 mL。
0.05 L,即50 mL。
(3)由于加入HNO3 0.8 mol,则若要放出H2时需将所有的HNO3消耗完。
3Fe+8H++2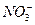 ====3Fe2++2NO↑+4H2O
====3Fe2++2NO↑+4H2O
3 2
n3 0.8 mol
n3(Fe)=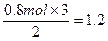 mol
mol
m(Fe)="1.2" mol×56 g·mol-1="67.2" g W>67.2 g
