问题
选择题
将1.92 g铜粉与一定量浓硝酸反应,当铜粉完全反应时收集到气体1.12 L(标准状况)。则所消耗硝酸的物质的量是( )
A.0.12 mol
B.0.11 mol
C.0.09 mol
D.0.08 mol
答案
答案:B
1.92 g铜,即0.03 mol铜,与硝酸完全反应,失去电子的物质的量为2×0.03 mol,若HNO3的还原产物仅为NO2,根据电子得失相等,n(NO2)=2×0.03 mol,
V(NO2)=2×0.03 mol×22.4 L·mol-1="1.344" L>1.12 L
说明:HNO3的还原产物不仅为NO2,还有NO,因为随着反应的进行,硝酸的浓度不断降低,必然发生如下两个反应:
Cu+4HNO3(浓)====Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)====3Cu(NO3)2+2NO↑+4H2O
消耗的硝酸的物质的量为:
n(HNO3)=2n〔Cu(NO3)2〕+n(NO2)+n(NO)=2×0.03 mol+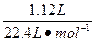 ="0.11" mol。
="0.11" mol。
