38.4 mg铜与一定量的浓硝酸反应,铜全部反应后,共收集到气体22.4 mL(标准状况),反应消耗硝酸的物质的量是( )
A.1×10-3 mol
B.1.6×10-3 mol
C.2.2×10-3 mol
D.2.4×10-3 mol
答案:C
解法1(极值法):若全部为NO2,根据化学反应方程式得其体积应为:
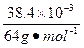 ×2×22.4 L·mol-1=26.88×10-3 L="26.88" mL。
×2×22.4 L·mol-1=26.88×10-3 L="26.88" mL。
故产生的气体为NO2和NO混合气。
若按Cu+4HNO3====Cu(NO3)2+2NO2↑+2H2O考虑,消耗HNO3量最大,
n(HNO3)=0.6×10-3 mol×4=2.4×10-3 mol
若按3Cu+8HNO3====3Cu(NO3)2+2NO↑+4H2O考虑,消耗HNO3量最少:
n(HNO3)=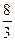 ×0.6×10-3 mol=1.6×10-3 mol
×0.6×10-3 mol=1.6×10-3 mol
实际消耗硝酸介于1.6×10-3 mol与2.4×10-3 mol之间。正确答案为C。
解法2(列方程求解):假设生成NO2物质的量为x,NO物质的量为y。
Cu+4HNO3====Cu(NO3)2+2NO2↑+2H2O
1 4 2
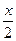 2x x
2x x
3Cu+8HNO3====3Cu(NO3)2+2NO↑+4H2O
3 8 2
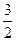 y 4y y
y 4y y
依题有: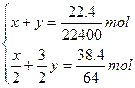
x=9×10-4 mol y=10-4 mol
所以消耗的HNO3物质的量:2x+4y=2×9×10-4 mol+4×10-4 mol=2.2×10-3 mol
选择C。
解法3(N守恒法):
反应中被还原的HNO3的物质的量为n(NOx)=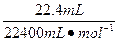 =10-3 mol
=10-3 mol
反应中起酸性作用的硝酸的物质的量为2n〔Cu(NO3)2〕=2×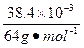 =1.2×10-3 mol
=1.2×10-3 mol
反应中共消耗硝酸的总物质的量=1.0×10-3 mol+1.2×10-3 mol=2.2×10-3 mol
选择C。
