问题
计算题
为了测定某铜银合金铁成分,将30.0 g合金完全溶于80 mL 13.5 mol·L-1的浓HNO3中,待合金完全溶解后,收集到6.72 L(标准状况)气体,并测得溶液的c(H+)="1" mol·L-1。假设反应后溶液的体积仍为80 mL,试计算:
(1)被还原的硝酸的物质的量;
(2)合金中银的质量分数。
答案
(1)0.3 mol (2)36%
(1)由于HNO3的还原产物为NO或NO2或二者的混合物,根据N原子守恒:则被还原的HNO3的物质的量等于气体的物质的量:
n(HNO3)=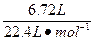 ="0.3" mol
="0.3" mol
(2)设合金中银的质量为x,则
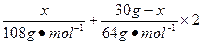 =13.5mol·L-1×0.08L-1mol·L-1×0.08L-0.3mol
=13.5mol·L-1×0.08L-1mol·L-1×0.08L-0.3mol
x="10.8" g
银的质量分数:
w(Ag)= ×100%=36%
×100%=36%
