某溶液中可能含有碳酸钠、硫酸钠、氯化钾、盐酸中的一种或几种,为测定其成分,进行如下实验。
第一步:取样,进行焰色反应,透过蓝色钴玻璃观察到火焰呈紫色。
第二步:另取样,先后逐滴加入氯化钡溶液、稀硝酸,产生沉淀的物质的量与时间的关系如下图所示。
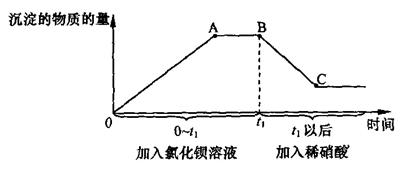
(1)由上述实验可知,原溶液中一定含有碳酸钠、硫酸钠和___________.
(2)第二步实验中,AB之间图像所对应的溶液中的溶质一定有________.
(3)BC段减少的沉淀是__________________.
(4)C点沉淀的物质的量为B点沉淀的物质的量的三分之一。原溶液中碳酸钠的物质的量(m1)与硫酸钠的物质的量(n2)的关系为m1=_______________。
(1)KCl或氯化钾(2)NaCl、BaCl2、KCl或氯化钠、氯化钡、氯化钾
(3)BaCO3或碳酸钡(4)2n2
(1)“焰色反应,透过蓝色钴玻璃观察到火焰呈紫色“可说明溶液中含钾,即含氯化钾。 加入氯化钡产生沉淀,说明可能含硫酸钠或碳酸钠。然后加入稀硝酸,沉淀部分溶解,则沉淀中未溶解的沉淀应为硫酸钡,则原来一定含硫酸钠;溶解的沉淀是碳酸钡,则原来一定含碳酸钠。所以原溶液中一定含硫酸钠、碳酸钠和氯化钾。
(2)A点是生成沉淀质量最大值的点,即A点表示碳酸钠和硫酸钠恰好与氯化钡完全反应。则AB段则表示氯化钡过量。
| 原溶液中的物质 | 与氯化钡是否反应 | 生成物 |
| KCl | 否 | |
| Na2CO3 | 是 | NaCl |
| Na2SO4 | 是 | NaCl |
(3)Na2CO3与BaCl2反应生成碳酸钡沉淀,Na2SO4与BaCl2反应生成硫酸钡沉淀;
其中碳酸钡沉淀可与稀硝酸反应生成硝酸钡、水和二氧化碳;所以BC段减少的沉淀是碳酸钡。
(4)C点时,碳酸钡沉淀全部反应,剩余的未反应的沉淀应为硫酸钡。据“C点沉淀的物质的量为B点沉淀的物质的量的三分之一”,即BC段减少的沉淀(碳酸钡)的物质的量占三分之二,C点沉淀(硫酸钡)的物质的量占三分之一。根据碳酸钡的物质的量=碳酸钠的物质的量;硫酸钡的物质的量=硫酸钠的物质的量。所以m1=2n2
点评:本题考查了物质间的反应,先根据实现现象推出原溶液的成分,现根据图像推出碳酸钠与硫酸钠的物质的量的比。
