问题
推断题
A﹣F和X都是初中化学中的常见物质,其中A、C是无色气体,B、F是红色固体,它们的转化关系如图所示(部分生成物已省略):
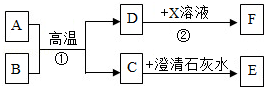
(1)写出反应①的化学方程式 。
(2)写出反应②的化学方程式 ,该反应属于 (填写基本反应类型)反应。
(3)含D的生产、生活用品腐蚀的过程,实际上是D与空气中的 发生化学反应的过程。
答案
(1)3CO+Fe2O3 2Fe+3CO2(2)Fe+CuSO4=FeSO4+Cu、置换
2Fe+3CO2(2)Fe+CuSO4=FeSO4+Cu、置换
(3)氧气和水(写化学式也可)
题目分析:B、F为红色固体,A、C为无色气体,因A、B在高温下可生成C、D,C又能与澄清石灰水反应,故C是二氧化碳;B是氧化铁;能在高温下与B氧化铁反应生成C二氧化碳的气体应是一氧化碳,所以A是一氧化碳;那么D就应是铁;一氧化碳能与氧化铁在高温下反应生成二氧化碳和铁,化学反应式是:3CO+Fe2O3 2Fe+3CO2;常见另一种红色固体F是铜,实现转化②,可由铁与硫酸铜溶液反应,反应化学式是:Fe+CuSO4=FeSO4+Cu,此反应属于置换反应;铁与空气中的氧和水反应,使铁被腐蚀。
2Fe+3CO2;常见另一种红色固体F是铜,实现转化②,可由铁与硫酸铜溶液反应,反应化学式是:Fe+CuSO4=FeSO4+Cu,此反应属于置换反应;铁与空气中的氧和水反应,使铁被腐蚀。
