(12)氨是重要的无机化工原料,也是合成氮肥的主要原料,因此合成氨在国民经济中占有重要地位。
⑴工业合成氨反应的化学方程式为 。
⑵恒温下,向一个2L的密闭容器中充入1mol N2和2.6mol H2,20min时,反应达到平衡,容器内c(NH3)为0.08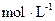 ,则c(H2)= ,20min内,用N2浓度的变化表示的反应速率为 。
,则c(H2)= ,20min内,用N2浓度的变化表示的反应速率为 。
⑶某温度下,向一个2L的密闭容器中充入1mol N2和3mol H2,在恒温下反应,以下能说明反应达到平衡状态的是
①单位时间内消耗0.1molN2的同时生成0.2molNH3
②单位时间内生成0.3molH2的同时生成0.2molNH3
③n(N2)∶n(H2 )∶n(NH3)=1∶3∶2
)∶n(NH3)=1∶3∶2
④c(NH3)=0.08mol/L
⑤容器内压强不变
⑷工业上约有80%的氨用于制造化肥。某化肥厂生产铵态氮肥(NH4)2SO4的反应可表示为:Ca SO4+2NH3+CO2+H2O= CaCO3+(NH4)2SO4
SO4+2NH3+CO2+H2O= CaCO3+(NH4)2SO4
①反应前先将CaSO4磨成粉末,加入水中制成悬浊液,则所得分散系中分散质粒子直径 10-7m(填“>”或“<”)。
②向CaSO4悬浊液中通入气体时,需先通入足量NH3再通入CO2,原因是 。
(12分,第⑴题3分,第⑷①题1分,其余每空2分)
⑴N2+3H2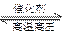 2NH3 ⑵1.18
2NH3 ⑵1.18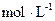 0.002
0.002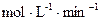 ⑶②⑤
⑶②⑤
⑷①> ②氨气极易溶于水,通入足量氨气使溶液呈碱性,有利于吸收CO2,增大c( ),促使CaSO4转化为CaCO3,以制得(NH4)2SO4。
),促使CaSO4转化为CaCO3,以制得(NH4)2SO4。
