问题
选择题
将1 mol 含镁物质的量分数为a的镁铝合金溶于含有b mol HNO3的稀溶液中,刚好完全反应,NO为唯一还原产物。向所得溶液中逐滴加入NaOH溶液至沉淀不再减少为止,将所得沉淀过滤、洗净、灼烧至恒重,所得固体质量与原合金质量相等。下列说法中正确的是
①合金含镁质量分数为60%②反应中放出气体体积在标准状况下为(1-a/3)× 22.4 L③反应过程中最大沉淀质量为(78-20a)g④反应中共消耗NaOH[b-(1-a/3)]mol
A.①②③
B.①②④
C.①③④
D.②③④
答案
答案:A
混合物中镁的物质的量为a mol,质量为24a g;混合物中铝的物质的量为(1—a )mol,质量为27(1—a )g;最后所得固体为MgO,根据镁元素守恒,MgO的物质的量为a mol,质量为40a g;所以可得:24a g+27(1—a )g="40a" g;a=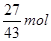
可求得:合金含镁质量分数为60%;镁、铝均可与稀硝酸反应生成NO,所以可得反应中放出气体体积在标准状况下为(1-a/3)× 22.4 L;反应过程中最大沉淀质量为镁、铝全部生成氢氧化物,所以可得最大沉淀质量为(78-20a)g;所以正确选项为A;
