(14分)氟和氟盐是化工原料。由于氟气性质活泼,很晚才制取出来。
(1)不能通过电解纯净的液态HF获得F2,其原因是 ;但电解液态KHF2时,两极分别得到F2和H2,写出阳极上HF2- 放电产生气体的电极反应式 。
(2)利用K2MnF6和SbF5在一定条件下发生反应也能制取氟,同时生成KSbF6和MnF3,化学方程式为 ,其中还原产物是 。
(3)已知氟化氢气体中存在下列平衡:H3F3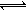 3HF △H>0, H2F2
3HF △H>0, H2F2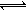 2HF △H>0。
2HF △H>0。
①若在定温定容条件下再充入H3F3,则H3F3与HF的浓度(mol/L)比值 (填“增大”“减小”或“不变”,下同);
②若在定温定容条件下再充入HF,则H3F3与HF 的浓度(mol/L)比值 。
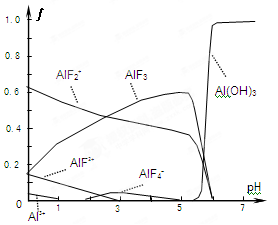
(4)一定浓度的HF和Al2(SO4)3混合液中,铝的各种微粒含量?随pH的分布曲线如图示。用NaOH使混合液的pH从5调整到7,写出有关反应的离子方程式为
。
_
(14分)
(4)AlF2++3OH-=Al(OH)3↓+2F-(2分),AlF3+3OH-=Al(OH)3↓+3F-(2分)
分析:(1))氟化氢是共价化合物,纯液态不导电;阳极发生氧化反应,HF2-在阳极上放电,生成F2与H+;
(2)反应中Mn元素化合价由+4价降低为MnF3中+3价,总共降低1价,F元素化合价由-1价升高为F2中0价,总共升高2价,化合价升降最小公倍数为2,所以MnF3系数为2,F2系数为1,再根据元素守恒配平其它物质的系数;
氧化剂发生还原反应生成的物质是还原产物;
(3)HF的电离平衡常数Ka= 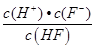 ,溶液pH=4,则溶液中c(H+)=10-4 mol?L-1,所以平衡时c(HF)=(0.10-1×10-4) mol?L-1≈0.10 mol?L-1,c(F-)=(0.10+1×10-4)mol?L-1≈0.10mol?L-1,代入电离平衡常数计算;
,溶液pH=4,则溶液中c(H+)=10-4 mol?L-1,所以平衡时c(HF)=(0.10-1×10-4) mol?L-1≈0.10 mol?L-1,c(F-)=(0.10+1×10-4)mol?L-1≈0.10mol?L-1,代入电离平衡常数计算;
(4)由图可知溶液pH=5时,混合液中铝的微粒为AlF2+、AlF3,pH值=7时,铝的微粒为Al(OH)3,即AlF2+、AlF3与OH-反应生成Al(OH)3、F-.
解:(1))氟化氢是共价化合物,纯液态时不电离,因而不导电,故不能通过电解纯净的液态HF获得F2;
阳极发生氧化反应,HF2-在阳极上放电,生成F2与H+,电极反应式为HF2--2e-=F2↑+H+,
故答案为:氟化氢是共价化合物,纯液态时不电离,因而不导电;HF2--2e-=F2↑+H+;
(2)反应中Mn元素化合价由+4价降低为MnF3中+3价,总共降低1价,F元素化合价由-1价升高为F2中0价,总共升高2价,化合价升降最小公倍数为2,所以MnF3系数为2,F2系数为1,根据锰元素守恒可知K2MnF6系数为2,根据K元素守恒可知KSbF6系数为4,根据Sb元素守恒可知SbF5系数为4,反应方程式为2K2MnF6+4SbF5=4KSbF6+2MnF3+1F2↑;
反应中Mn元素化合价由K2MnF6中+4价降低为MnF3中+3价,K2MnF6发生还原反应生成MnF3,MnF3是还原产物.
故答案为:2;4;4;2;1;MnF3;
(3)解:溶液pH=4,则溶液中c(H+)=10-4 mol?L-1,
HF  H++F-
H++F-
开始( mol?L-1):0.10 0 0.10
平衡( mol?L-1):(0.10-1×10-4) 1×10-4(0.10+1×10-4)
c(HF)=(0.10-1×10-4) mol?L-1≈0.10 mol?L-1
c(F-)=(0.10+1×10-4)mol?L-1≈0.10mol?L-1
Ka=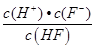 =
=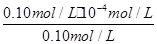 =1.0×10-4 mol?L-1,
=1.0×10-4 mol?L-1,
答:该温度下HF的电离平衡常数近似为1.0×10-4 mol?L-1;
(4)由图可知溶液pH=5时,混合液中铝的微粒为AlF2+、AlF3,pH值=7时,铝的微粒为Al(OH)3,即AlF2+、AlF3与OH-反应生成Al(OH)3、F-,反应离子方程式为AlF2++3OH-=Al(OH)3↓+2F-、AlF3+3OH-=Al(OH)3↓+3F-,
故答案为:AlF2++3OH-=Al(OH)3↓+2F-、AlF3+3OH-=Al(OH)3↓+3F-.
