问题
填空题
已知某反应中反应物与生成物有:HNO3、Cu(NO3)2、NO、Cu、H2O
(1)已知Cu在反应中失去电子,则该反应的氧化剂是______.
(2)该反应中,发生还原反应的过程是(写化学式)______→______.
(3)将反应物的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:
(4)如有1.5mol Cu参加反应,有______mol HNO3参加反应,被还原的HNO3的物质的量是______mol.转移电子的物质的量是______ mol.
答案
(1)Cu在反应中失去电子,所以金属铜是还原剂,HNO3中的N元素处于最高价,所以硝酸具有氧化性,做氧化剂,故答案为:HNO3;
(2)该反应是金属铜和硝酸的反应,化合价降低的N元素发生还原反应,即从硝酸的+5价氮元素降为NO中的+2价氮元素,故答案为:HNO3→NO;
(3)该反应是金属铜和硝酸的反应,根据电子守恒来配平化学方程式为:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O,电子转移的方向和数目如下所示:
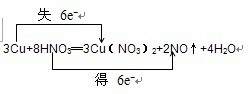
,或
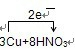
,故答案为:

;
(4)根据化学方程式可以看出:当有3mol金属铜参加反应时,就有8mol的硝酸参与反应,转移电子为6mol,所以当有1.5mol金属铜参加反应时,就有4mol的硝酸参与反应,被还原的HNO3的物质的量是参加反应硝酸物质的量的四分之一,即被还原的HNO3的物质的量是1mol,转移电子为3mol,故答案为:4;1;3.
