氯化钠和氯化镁是重要的化工原料。某粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4等物质,为了从中提取较纯的氯化镁和氯化钠,设计以下实验方案:
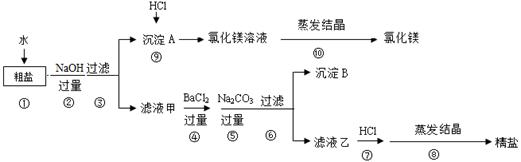
请回答下列问题:
Ⅰ.步骤①溶解过程中用玻璃棒搅拌的目的是 。
Ⅱ.步骤④⑤的顺序颠倒会引发的后果是 。
Ⅲ.滤液乙中所含的溶质除氯化钠外还含有 ;沉淀B中除含碳酸钙、碳酸钡外还含有 ;在步骤⑦中若加入的盐酸略过量是否对实验结果有影响?原因是 。
Ⅳ.写出步骤⑨中反应的化学方程式 。
Ⅴ.实验最终所得的精盐的质量大于粗盐中氯化钠的质量,整个过程中产生新的NaCl的反应共有 个。
Ⅰ加快溶解的速度
Ⅱ精盐中会混有氯化钡或无法除去过量的氯化钡
Ⅲ 氢氧化钠、碳酸钠 硫酸钡 无影响,加热蒸发时氯化氢会挥发
Ⅳ Mg(OH)2+2HCl →Mg Cl2+2H2O
Ⅴ 6
题目分析:Ⅰ溶解过程中用玻璃棒搅拌的目的是:加快溶解的速度
Ⅱ步骤⑤,加入过量的碳酸钠,不仅是除去粗盐中的氯化钙,还起到除去步骤④中所加的过量的氯化钡,所以步骤④⑤的顺序颠倒会引发的后果是:精盐中会混有氯化钡或无法除去过量的氯化钡
Ⅲ步骤②④⑤所加的试剂都是过量,但步骤④所加的氯化钡可以被碳酸钠反应掉,所以滤液乙中所含的溶质除氯化钠外还含有:氢氧化钠、碳酸钠,沉淀B中除含碳酸钙、碳酸钡外还含有所加的氯化钡与粗盐中的杂质Na2SO4反应生成的硫酸钡,步骤⑦中若加入的盐酸虽然略过量,但由于它是氯化氢气体的水溶液,所以实验结果没有影响,原因是:加热蒸发时氯化氢会挥发
Ⅳ步骤⑨中反应的化学方程式:Mg(OH)2+2HCl →Mg Cl2+2H2O
Ⅴ步骤②:MgCl2+2NaOH=Mg(OH)2↓+2NaCl,步骤④:Na2SO4+BaCl2=BaSO4↓+2NaCl,步骤⑤发生2个反应:CaCl2+Na2CO3=CaCO3↓+2NaCl,BaCl2+Na2CO3=BaCO3↓+2NaCl,步骤⑦也发生2个反应:NaOH+HCl=NaCl+H2O,Na2CO3+2HCl=2NaCl+H2O+CO2↑,所以整个过程中产生新的NaCl的反应共有6个
