(14分)下图为某实验者设计的验证银圆(银和铜的合金)完全溶解于一定量的浓硝酸后生成NO2气体中含有NO的实验装置图。常温时,NO2与N2O4同时存在;在低于0℃时,几乎只有无色的N2O4的晶体存在。
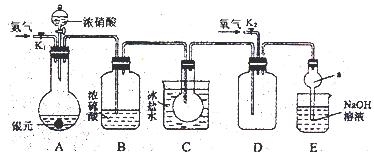
(1)反应前先打开A中的活塞K1,持续通一段时间N2,其理由是 。
(2)若装置中缺B,其后果是 。
(3)反应结束后,打开D中的活塞K2,并通入氧气,D瓶内气体由无色变为红棕色;若通入的是热氧气,则瓶内气体的颜色比以前更深,其原因是 。
(4)C装置的作用是 ;E中a仪器所起的作用是 。
(5)已知该银圆的质量为25g,加入75mL 12mol·L—1的浓硝酸。实验结束后,A中烧瓶内溶液中H+的浓度为2mol·L—1(反应中HNO3既无挥发也无分解),溶液体积仍为75mL。
①参加反应的硝酸的物质的量是 。
②为测定该银圆中铜的质量分数,还需进行的主要实验操作是 。
(1)赶走装置中的空气,防止干扰实验。
(2)无法确认铜与硝酸反应是否生成了NO气体
(3)热的空气使平衡 2NO2  N2O4向逆方向移动,导致颜色加深
N2O4向逆方向移动,导致颜色加深
(4)将NO2 和NO分开(或除去二氧化氮气体) 防倒吸
(5) 0、75mol 向反应后的溶液中加入足量的盐酸,过滤洗涤称量干燥沉淀的质量
题目分析:(1)由于装置中含有空气,而空气能把NO氧化生成NO2,从而干扰实验的检验,所以这样操作的目的是赶走装置中的空气,防止干扰实验。
(2)由于生成的气体中含有水蒸气,而NO2能和水反应生成NO,从而无法确认铜与硝酸反应是否生成了NO气体,所以不能缺少B装置。
(3)由于存在可逆反应2NO2 N2O4,由于该反应是放热反应,所以热的空气可以使平衡 2NO2
N2O4,由于该反应是放热反应,所以热的空气可以使平衡 2NO2 N2O4向逆方向移动,因此NO2浓度增大,从而导致颜色加深。
N2O4向逆方向移动,因此NO2浓度增大,从而导致颜色加深。
(4)由于在低于0℃时,几乎只有无色的N2O4的晶体存在,所以C装置的目的是通过降温将NO2 和NO分开(或除去二氧化氮气体)。由于NO2极易被氢氧化钠溶液吸收,如果直接插入会导致溶液的倒流,所以E中a仪器所起的作用是防倒吸。
(5)①硝酸的总的物质的量是0.9mol,剩余硝酸是0.15mol,所以参加反应的硝酸是0.9mol-0.15mol=0.75mol。
②由于反应后金属生成了硝酸盐,所以要测定该银圆中铜的质量分数,还需要把金属阳离子变成沉淀,然后通过称量即可计算,所以正确的操作可以是向反应后的溶液中加入足量的盐酸,过滤、洗涤、干燥、称量沉淀的质量。
点评:化学是一门以实验为基础的学科,所以有化学实验即科学探究之说法。化学实验主要以考察探究性实验和物质制备实验为主。这些探究性和制备性实验的试题,综合性强,理论和实践的联系紧密,有的还提供一些新的信息,要求学生必须认真审题,通过联系所学过的知识和技能,灵活运用并进行知识的类比、迁移、重组,全面细致的思考才能作出正确的解答。
