(15分)亚硝酸钠是一种工业盐,现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。
已知:①NO+NO2+2OH-=2NO2-+H2O
②气体液化的温度:NO2 21℃、NO -152℃
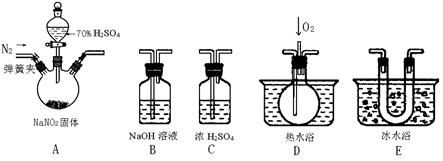
(1)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接):
A 、C、 、 、 。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是:
。
(3)在关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是 。
②装置E的作用是 。
(4)如果向D中通入过量O2,则装置B中发生反应的化学方程式为 。如果没有装置C,对实验结论造成的影响是 。
(5)通过上述实验探究过程,可得出装置A中反应的化学方程式是 。
(1)E、D、B (3分)
(2)防止可能生成的NO被完全氧化成NO2,造成对A中反应气体产物检验不完全(2分)
(3)①D中出现红棕色气体(2分)②冷凝使NO2完全液化(2分)
(4)4NO2 + O2 + 4NaOH = 4NaNO3 +2 H2O(2分)
水蒸气存在,会与NO2反应产生NO,造成对NO来源于哪里的认识不清(2分)
(5)2NaNO2 + H2SO4 = Na2SO4 + NO2↑ + NO↑+ H2O(2分)
(1)由于NO2的液化温度高,所以首先检验NO2,即先通过E,然后再通过D。最后需要有尾气处理,即答案是EDB。
(2)空气中的氧气能氧化NO,所以必须先排尽空气,防止可能生成的NO被完全氧化成NO2,造成对A中反应气体产物检验不完全。
(3)①如果有NO,则经过装置E的冷却后,进入D中的气体,能和氧气反应,生成红棕色气体,即现象是D中出现红棕色气体。
②装置E的作用是冷凝使NO2完全液化。
(4)氧气过量,则进入B装置的气体全部是NO2,所以反应的方程式为4NO2 + O2 + 4NaOH = 4NaNO3 +2 H2O。如果不干燥气体,则水蒸气存在,会与NO2反应产生NO,造成对NO来源于哪里的认识不清。
(5)根据现象可知,亚硝酸钠与硫酸反应生成物既有NO2,还有NO,所以方程式为2NaNO2 + H2SO4 = Na2SO4 + NO2↑ + NO↑+ H2O。
