问题
计算题
把19.2 g的Cu放入足量的稀硝酸中,微热至Cu完全反应。
已知:3Cu + 8HNO3(稀) = 3Cu(NO3)2 +2NO↑+ 4H2O求:
(1)参加反应的硝酸的物质的量;
(2)被还原的硝酸的质量;
(3)生成的NO在标准状况下的体积。
答案
(1)0.8mol;(2)12.6g; (3)4.48L。
题目分析:(1)19.2g铜的物质的量是19.2g÷64g/mol=0.3mol
所以依据化学方程式可知
参加反应的硝酸的物质的量为: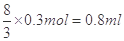
(2)铜在反应中失去电子0.3mol×2=0.6mol,根据方程式可知,氮元素的化合价从+5价降低到+2价,得到3个电子实验根据电子的得失守恒可知,被还原的硝酸的物质的量是0.6mol÷3=0.2mol,质量是0.2mol×63g/mol=12.6g。
(3)被还原的硝酸的物质的量是0.2mol,则根据氮原子守恒可知,生成的NO的物质的量是0.2mol,则在标准状况下的体积是0.2mol×22.4L/mol=4.48L
