(共14分)某同学用下列装置(固定、加热仪器和橡胶管略)进行有关氨气制取及其相关实验的探究,回答下列问题.
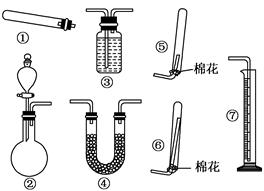
(1)若用装置①制取NH3,其反应的化学方程式为 ;若要测定生成的NH3的体积,则必须选择的装置是 (填装置序号),装置中所盛试剂应具有的性质是 .
(2)若用装置②制取并收集干燥的NH3,收集装置应选择 (填装置序号).
(3)在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙(粒子直径在1—10nm之间)。
①向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入的气体是 ,试写出制纳米级碳酸钙的离子方程式 ;
②在浓CaCl2溶液和NH3用量正确的情况下,CO2不足或过量都会导致纳米级碳酸钙产量下降,若CO2过量溶液中大量存在的离子有(不考虑弱电解质的电离和盐类水解产生的少量离子)_____________________________。
(每空2分,共14分)
(1)2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O、③⑦
2NH3↑+CaCl2+2H2O、③⑦
氨气难溶于该试剂,该试剂不易挥发,不与氨气反应。
(2)⑥
(3)①NH3、 Ca2++2NH3+H2O+CO2=CaCO3+2NH4+
②Ca2+ HCO3- NH Cl-
Cl-
(1)实验室制取氨气的方程式是2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O。要测定生成的氨气体积,则需要通过排液法,因此装置中所盛放的液体必须满足氨气难溶于该试剂,该试剂不易挥发,且不与氨气反应。
2NH3↑+CaCl2+2H2O。要测定生成的氨气体积,则需要通过排液法,因此装置中所盛放的液体必须满足氨气难溶于该试剂,该试剂不易挥发,且不与氨气反应。
(2)氨气极易溶于水,但氨气的密度小于空气的,所以采用向下排空气法收集,即选择装置⑥。
(3)①由于CO2难溶于水,而氨气极易溶于水,所以首先通入的是氨气,钙反应的离子方程式是Ca2++2NH3+H2O+CO2=CaCO3+2NH4+。
②如果CO2过量,则生成碳酸氢钙,所以溶液中大量存在的离子是Ca2+、HCO3-、NH 、Cl-。
、Cl-。
