(7分)化学课上,同学们做了如下两个实验。
| 实验装置 | 实验现象 | 实验结论 |
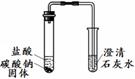  实验Ⅰ 实验Ⅱ | 实验I、II中均观察到:白色固体逐渐减少, ;澄清石灰水变浑浊。 | Na2CO3和NaHCO3都能与盐酸反应产生CO2;NaHCO3与盐酸反应的化学方程式是 。 |
【提出问题】两个实验过程中,温度变化的原因是什么?
【猜想与假设】甲同学认为:Na2CO3和盐酸反应为放热反应,而NaHCO3和盐酸反应为吸热反应。
乙同学认为甲的猜想有不足之处。
【设计实验】乙同学欲通过实验进行研究,实验步骤如下:
①分别向盛有0.5 g Na2CO3固体、0.5 g NaHCO3固体的烧杯中加入10 mL水(20℃),搅拌,测量温度t1
②静置,测量温度t2
③分别加入10 mL 密度约为1.1 g/mL 20%的盐酸(20℃),搅拌,测量温度t3
【实验记录】多次实验后取平均值记录如下:
| t1/℃ | t2/℃ | t3/℃ | |
| Na2CO3 | 23.3 | 20.0 | 23.7 |
| NaHCO3 | 18.5 | 20.0 | 20.8 |
(1)甲同学猜想的不足之处是 。通过步骤①得到的结论是 。
(2)通过步骤②和③得到的结论是:Na2CO3和NaHCO3与盐酸反应都是放热反应。
【反思与评价】
老师指出乙的设计仍存在不足,并补充做如下实验:向盛有10 mL水(20℃)的烧杯中加入10 mL密度约为1.1 g/mL 20%的盐酸(20℃),搅拌,测量温度为22.2℃。
(1)此实验的目的是 。
(2)结合此次探究活动,你认为下列说法不正确的是 (填序号)。
A.盐酸的稀释过程是放热过程
B.NaHCO3与盐酸的反应是放热反应
C.实验Ⅰ和Ⅱ中的能量变化与化学反应、物质的溶解和稀释有关
有气泡冒出; NaHCO3 + HCl=NaCl+ H2O+ CO2↑;【分析与结论】(1)没有考虑固体溶解时的温度变化;Na2CO3固体溶解放热,NaHCO3固体溶解吸热;【反思与评价】(1)探究盐酸稀释过程中的温度变化;(2)B
题目分析:碳酸钠与盐酸反应会生成二氧化碳;碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳;【分析与结论】碳酸钠溶于水也放出热量,不能说明是盐酸与碳酸钠反应放出的热量;分析表中的数据即可得到答案;【反思与评价】(1)由实验内容可知,这是探究盐酸溶于水时的温度变化;(2)结合前面的探究活动,可知碳酸氢钠与盐酸反应时的温度升高可能是盐酸溶解时放出的热量,不能说明是碳酸氢钠与盐酸反应放出热量。
