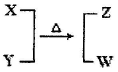
(12分)X、Y、Z、W为电子数相同的分子或离子。X有5个原子核。通常状况下,W为无色液体。它们之间转化关系如图所示,请回答:
(1)工业上每制取1molZ要放出46.2 kJ的热量,写出该反应的热化学方程式: 。
(2)实验室制取Z的方法不止一种,写出其中一种方法的化学方程式: 。
(3)某化学小组同学模拟工业生产制取HNO3,设计下图所示装置,其中a为一个可持续鼓入空气的橡皮球。
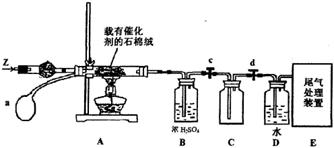
①A中发生反应的化学方程式是 。
②B中浓H2SO4的作用是 。
(4)写出D装置中反应的化学方程式 。
(5)向含有ag HNO3的稀溶液中,加入bg铁粉充分反应,铁粉全部溶解。已知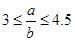 ,则被还原的HNO3的质量为 g。
,则被还原的HNO3的质量为 g。
(1)N2(g)+3H2(g)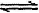 2NH3(g) △H="-92.4" kJ/mol
2NH3(g) △H="-92.4" kJ/mol
(2)2NH4Cl+Ca(OH)2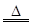 2NH3↑+2H2O+CaCl2或NH3·H2O
2NH3↑+2H2O+CaCl2或NH3·H2O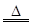 NH3↑+H2O
NH3↑+H2O
(3)①4NH3+5O2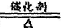 4NO+6H2O ②吸收H2O(g)和未反应的NH3
4NO+6H2O ②吸收H2O(g)和未反应的NH3
(4)3NO2+H2O=2HNO3+NO (5)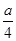
题目分析:W为无色液体,一般是H2O,即有10个电子,X有5个原子核且有10个电子,可推断出是NH4+,则Y为OH-,Z为NH3。
(1)工业上合成氨,是用氢气和氮气直接合成,反应方程式为N2(g)+3H2(g)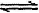 2NH3(g) △H="-92.4" kJ/mol
2NH3(g) △H="-92.4" kJ/mol
(2)氨的实验室制法,一般是加热铵盐和碱的混合物。
(3)(4)氨经过一系列反应可以得到硝酸,其过程可表示为N2 —NH3—NO—NO2—HNO3。
(5)当铁不足时,此反应的方程式为
4HNO3+Fe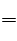 Fe(NO3)3+NO+2H2O
Fe(NO3)3+NO+2H2O
4 1
b/14 b/56
则(b/14)=(a/63) 得a/b=4.5
当铁过量时,剩余的铁能继续和Fe(NO3)3反应,该反应方程式为
8HNO3+3Fe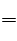 3Fe(NO3)2+2NO+4H2O
3Fe(NO3)2+2NO+4H2O
8 3
b/56 b/21
则 b/21=(a/63) 得a/b=3
又因为(a/b)大于等于3,小于等于4.5,说明该反应介于刚才所列举的两者之间,即反应方程式为
4Fe+12HNO3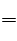 3Fe(NO3)2+Fe(NO3)3+3NO+6H2O
3Fe(NO3)2+Fe(NO3)3+3NO+6H2O
12 3
a a/4
即被还原的硝酸的质量为(a/4)g。
点评:本题通过推断,判断出N元素的相关物质,主要考察书上关于NH3及HNO3的制法的化学方程式,学生可以根据所学知识进行解答,难度不大。
