(12分)某课外小组模拟工业流程,设计了如下实验装置制备硝酸(所有橡胶制品均已被保护)。
(1)分别写出工业上用氨气制取NO及实验室用浓硝酸制取NO 的化学方程式:______________;___________________。
的化学方程式:______________;___________________。
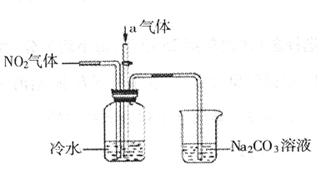
(2)连接好该装置后,首先进行的操作是:_____________________。
(3)通入的气体a是______________(填化学式),通入a的目的是:___________。
(4)盛有Na CO
CO 溶液的烧杯为尾气处理装置,该装置中反应的化学方程式是:
溶液的烧杯为尾气处理装置,该装置中反应的化学方程式是:
_______NO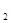 +_______Na
+_______Na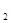 CO
CO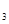 +_______H
+_______H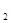 O=NaNO
O=NaNO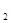 +_______+_______NaHCO
+_______+_______NaHCO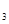 (完成此方程式)
(完成此方程式)
(5)用N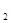 O
O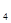 代替NO
代替NO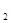 与水和a气体反应可生成硝酸,此反应的化学方程式是:
与水和a气体反应可生成硝酸,此反应的化学方程式是:
____________________________________。
(12分) (1)4NH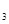 +5O
+5O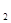
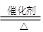 4NO+6H
4NO+6H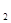 O (2分)
O (2分)
Cu+4HNO3(浓)=Cu(NO3)2+2NO2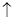 +2H2O(2分)
+2H2O(2分)
(2)检验装置的气密性(1分)
(3)O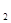 (1分) 可提高NO
(1分) 可提高NO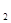 的转化率(或2NO+O
的转化率(或2NO+O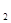 =2NO
=2NO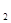 )(2分)
)(2分)
(4)2NO2+2Na2CO3+1H2O=NaNO2+NaNO3+2NaHCO3(NaNO31分,系数1分)
(5)2N2O4+O2+2H2O=4HNO3(2分)
题目分析:(1)氨气发生催化氧化生成NO,反应的化学方程式是4NH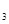 +5O
+5O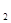
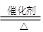 4NO+6H
4NO+6H O。实验室制取NO2常用浓硝酸和金属铜,反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+2NO2
O。实验室制取NO2常用浓硝酸和金属铜,反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+2NO2 +2H2O。
+2H2O。
(2)连接好该装置后,首先进行的操作应该是检验装置的气密性。
(3)由于NO2溶于水生成硝酸的同时,还生成NO,所以需要通入氧气氧化NO,再生成NO2,从而提高NO2的转化率。
(4)根据电子的得失守恒可配平该反应的化学方程式,即2NO2+2Na2CO3+H2O=NaNO2+NaNO3+2NaHCO3。
(5)N2O4和氧气溶于水生成硝酸,反应的化学方程式是2N2O4+O2+2H2O=4HNO3。
点评:该题是基础性试题的考查,考查的知识点比较多,但考查的都很基础,只要学生有扎实的基础以及灵活应变能力,即不能得出正确的答案。
