问题
计算题
在密闭容器中充入NO和CO2混合气体,其密度是相同条件下氨气气体密度的2倍,这时测得容器内的压强为P1,若控制容器的体积不变时,加入足量的Na2O2,充分振荡至反应完全,恢复到开始时的温度,再次测得容器内压强为P2,则P1和P2的比值?
答案
(共7分)7:5
题目分析:密度是相同条件下氨气气体密度的2倍
所以混合气的平均相对分子质量是17×2=34
因此NO和CO2的体积之比是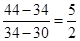
2CO2+2Na2O2=2Na2CO3+O2、O2+2NO=2NO2
即相当于是CO2+NO+Na2O2=Na2CO3+NO2
所以反应后生成NO2是2体积,剩余NO是3体积
则P1和P2的比值是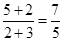 2和过氧化钠反应的有关计算
2和过氧化钠反应的有关计算
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的训练,有利于提高学生的逻辑推理能力和抽象思维能力。该题的关键是明确反应的原理,然后结合方程式灵活运用即可。
