问题
填空题
高锰酸钾和盐酸溶液可以发生以下反应:
2KMn04+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(1)用双线桥标出该反应中电子转移的方向和数目.
(2)该反应的氧化产物是______.
(3)若消耗0.2mol氧化剂,则被氧化的还原剂的物质的量是______mol.
答案
根据反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中元素化合价的变化,可得该反应电子转移的方向和数目如下所示:
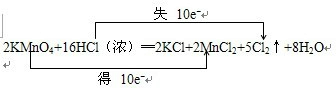
,故答案为:

;
(2)化合价升高的元素是浓盐酸中的氯元素,所得到的氧化产物是氯气,故答案为:Cl2;
(3)高锰酸钾是氧化剂,还原剂是浓盐酸,2mol高锰酸钾氧化剂消耗的16mol浓盐酸中,只有10mol浓盐酸做还原剂,所以氧化剂和被氧化的还原剂的量之间的关系为:2KMn04~10HCl,若消耗0.2mol氧化剂,则被氧化的还原剂的物质的量1mol,故答案为:1.
