问题
问答题
实验室里用浓盐酸和二氧化锰共热制Cl2:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O △ .
(1)用“线桥法”表示出电子转移情况:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O △ .
(2)该反应中,氧化剂是______,还原剂是______.
(3)当转移电子的数目为6.02×1023个时生成的氯气在标准状况下的体积为______L.
答案
(1)化合价升高元素是氯元素,失电子,化合价降低元素是锰元素,得到电子,化合价升高数=化合价降低数=转移电子数=2,电子转移情况如下:
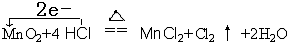
,故答案为:
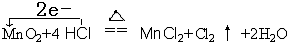
;
(2)化合价降低元素所在的反应物MnO2是氧化剂,化合价升高元素所在的反应物HCl是还原剂,故答案为:MnO2;HCl;
(3)反应MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O转移电子2mol时,生成的氯气物质的量为1mol,当转移电子的数目为6.02×1023个即1mol时,生成的氯气物质的量为0.5mol,体积为:0.5mol×22.4L/mol=11.2L,故答案为:11.2. △ .
