已知A经如右图所示的过程转化为D, 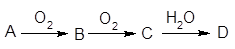
请回答下列问题:
(1)若A为非金属单质,且常温下为淡黄色固体,B为刺激性气味的无色气体,能使品红溶液褪色,D为强酸。
①D的化学式是 。
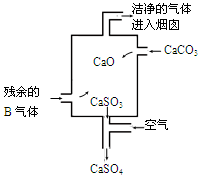
②在工业生产中B气体的大量排放被雨水吸收后形成了 而污染了环境。某工厂净化残余的B气体装置如图,则除去B气体的总反应方程式是 。
(2)若A是能使酚酞试液变红的气体。D是一种强酸。写出A→B的化学方程式 ;工业生产上,以34吨A为原料,最多可以生产63%的D酸 吨。
(1)①H2SO4(2分)②酸雨(1分);2SO2 +2CaCO3+O2= 2CaSO4+2CO2(2分)
(2) 4NH3+5O2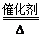 4NO+6H2O (2分);200(2分)
4NO+6H2O (2分);200(2分)
题目分析:(1)若A为非金属单质,且常温下为淡黄色固体,则A是单质S。硫在氧气中燃烧生成SO2,SO2是刺激性气味的无色气体,则B是SO2,SO2能使品红溶液褪色。SO2氧化得到三氧化硫,三氧化硫溶于水生成硫酸,即D为强酸硫酸。
①D的化学式是H2SO4。
②在工业生产中SO2气体的大量排放被雨水吸收后形成了酸雨而污染了环境。根据示意图可知,碳酸钙高温分解生成氧化钙和CO2,氧化钙吸收SO2生成亚硫酸钙。亚硫酸钙不稳定,被空气中的氧气氧化生成硫酸钙,从而防止空气污染,因此反应的总化学方程式为2SO2 +2CaCO3+O2=2CaSO4+2CO2。
(2)若A是能使酚酞试液变红的气体,则A是氨气。氨气在氧气中发生催化氧化生成NO和水。NO被氧气氧化生成NO2,NO2溶于水生成强酸硝酸,因此A→B的化学方程式为4NH3+5O2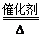 4NO+6H2O。根据氮原子守恒可知:
4NO+6H2O。根据氮原子守恒可知:
NH3~~~~HNO3
17t 63t
34t m×63%
解得m=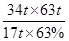 =200t
=200t
