甲.乙两个研究性学习小组为测定氨分子中氮.氢原子个数比,设计了如下实验流程:

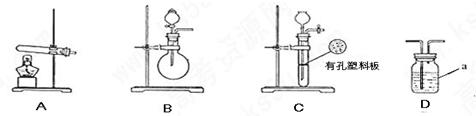
下图A.B.C为甲.乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。
实验开始前装置中的空气已排尽。甲小组测得:反应前氧化铜的质量为 .氧化铜反应后剩余固体的质量为
.氧化铜反应后剩余固体的质量为 .生成氮气在标准状况下的体积
.生成氮气在标准状况下的体积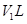 。乙小组测得洗气装置D前后的质量和生成氮气在标准状况下的体积。
。乙小组测得洗气装置D前后的质量和生成氮气在标准状况下的体积。
(1)写出仪器a的名称: 。
(2)甲.乙两小组选择了不同方法制取氨气,请将实验装置的字母编号和制备原理填写在下表空格中。
| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙.硫酸铵 | 反应的化学方程式为 ① |
| 乙小组 | ② | 浓氨水.氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: ③
|
(3)甲小组用所测数据计算出氨分子中氮.氢的原子个数之比为 。
(4)在操作和计算正确的情况下,乙小组用所测数据计算出氨分子中氮.氢的原子个数比明显小于理论值,其原因可能是 。
(5)乙小组在原有实验的基础上增加了一个装有药品的实验仪器,重新实验,得出合理的实验结果。该药品的名称是 。
(1)(2分)广口瓶
(2)①(1分)(NH4)2SO4+Ca(OH)2 2NH3↑+2H2O+CaSO4(2分) ②B(1分)
2NH3↑+2H2O+CaSO4(2分) ②B(1分)
③(2分)氢氧化钠溶于氨水后放热,增加氢氧根浓度,使NH3+H2O NH3·H2O
NH3·H2O NH4++OH-向逆反应方向移动,加快氨气逸出(2分)
NH4++OH-向逆反应方向移动,加快氨气逸出(2分)
5V1:7(m1-m2) (2分)
浓硫酸吸收了未反应的氨气,从而使计算出的氢含量偏高(2分)
(5)碱石灰(氢氧化钠.氧化钙等)(2分)
题目分析:(2)浓氨水.氢氧化钠不需加热,能控制液体用量,容器空间较大。选B。
(3)解:设H的物质的量为y
nN2=V/22.4 nN= V/11.2 CuO--- Cu----O --------2H---- H2O
16 2
(m1-m2)y y= (m1-m2)/8
氮.氢的原子个数之比为: V/11.2 : (m1-m2)/8=5V1:7(m1-m2)