研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义。
⑴一定条件下,NO2与SO2反应生成SO3和NO两种气体。将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________(填字母)。
a.体系压强保持不变 b.混合气体颜色保持不变
c.体系中SO3的体积分数保持不变 d.每消耗1 mol SO2的同时生成1 mol NO
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=________。
⑵新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为________(写出一种即可)。
⑶右图是MCFC燃料电池,它是以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质。A为电池的________(填“正”或“负”)极,写出B极电极反应式:________________________。

⑷工业上常用Na2CO3溶液吸收法处理氮的氧化物(以NO和NO2的混合物为例)。
已知:NO不能与Na2CO3溶液反应。
NO+NO2+Na2CO3=2NaNO2+CO2
2NO2+Na2CO3=NaNO2+NaNO3+CO2
①用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4 L(标准状况)CO2(全部逸出)时,吸收液质量就增加44 g,则混合气体中NO和NO2的体积比为
____________。
②用Na2CO3溶液吸收法处理氮的氧化物存在的缺点是____________。
(1)bc 2.67或8/3,(2)(NH4)3PO4或(NH4)2HPO4或NH4H2PO4
(3)负 O2+4e-+2CO2=2CO32-,(4)①1∶7
②对于含NO较多混合气体无法完全吸收,因为NO不能与Na2CO3溶液反应(意思相近均给分)
(1)a.随反应进行,气体的物质的量不变,压强不变,体系压强保持不变,不能说明到达平衡状态,a错误;b.混合气体颜色保持不变,说明二氧化氮的浓度不变,说明到达平衡状态,b正确;c.随反应进行NO和O2的物质的量之比发生变化,NO和O2的物质的量之比保持不变,说明到达平衡状态,c正确;d.每消耗1mol SO2的同时生成1mol NO都表示正反应速率,反应自始至终都按此比例进行,d错误.
选:bc.
NO2(g)+SO2(g)?SO3(g)+NO(g)
起始物质的体积 a 2a 0 0
转化物质的体积 x x x x
平衡物质的体积 a-x 2a-x x x
平衡时NO2与SO2体积比为1:6,即(1a-x):(2a-x)=1:6,故x=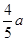 ,故平衡常数K
,故平衡常数K
=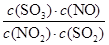 =
= =
= ≈2.67,
≈2.67,
(2)氨气是碱性气体,可以和磷酸反应生成盐,产生的盐随着酸的磷酸的量的多少而不同,可以产生磷酸铵,磷酸氢铵或是磷酸二氢铵;
(3)碳酸盐燃料电池中通氧气的电极一定为正极,通入燃料的电极一定为负极,氧气在该电极上发生还原反应;
(4)①设NO的物质的量是x,NO2的物质的量是y,则
x+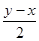 =
=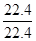 mol;
mol;
32x+24(y-x)=44
解得:x= ,y=
,y=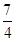 ;即一氧化氮和二氧化氮的物质的量之比
;即一氧化氮和二氧化氮的物质的量之比 :
: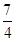 =1:7,所以相同条件下,一氧化氮和二氧化氮的体积之比是1:7,故答案为:1:7.
=1:7,所以相同条件下,一氧化氮和二氧化氮的体积之比是1:7,故答案为:1:7.
②NO不能与Na2CO3溶液反应,所以对于含NO较多混合气体无法完全吸收,故答案为:含NO较多混合气体无法完全吸收;
