硝酸铵是一种常用的化肥,其工业生产流程如下图,请回答下列问题。
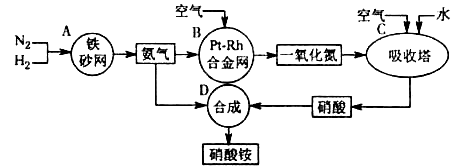
⑴写出反应容器B中发生反应的化学方程式: 。
⑵吸收塔C中通入空气的目的是 ;C、D两个反应容器中发生的反应,属于氧化还原反应的是 (填反应容器代号)。
⑶浓硝酸一般保存在棕色试剂瓶里,并放置在阴凉处,用化学方程式解释原因: 。
⑷金属铜与稀硝酸反应的离子方程式是 ,该反应中稀硝酸表现的性质是 。
⑴4NH3+5O2 4NO+6H2O ⑵将一氧化氮氧化成二氧化氮 ; C
4NO+6H2O ⑵将一氧化氮氧化成二氧化氮 ; C
⑶4HNO3 4NO2↑+O2↑+2H2O ⑷3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O 酸性和氧化性
4NO2↑+O2↑+2H2O ⑷3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O 酸性和氧化性
题目分析:氮气与氢气在铁触媒的作用下反应产生氨气,氨气在Pt-Rh合金作用下加热被空气中的氧气氧化为NO和水,NO在吸收塔中与氧气反应产生二氧化氮气体,二氧化氮被水吸收得到硝酸和NO。硝酸与氨气作用形成硝酸铵。⑴反应容器B中发生反应的化学方程式为4NH3+5O2 4NO+6H2O;⑵在吸收塔C中通入空气的目的是为了将一氧化氮氧化成二氧化氮;在C中发生反应:2NO+O2=2NO2;3NO2+ H2O == 2HNO3+ NO。在D中发生反应:HNO3+NH3=NH4NO3.前两个反应是氧化还原反应,第三个不是氧化还原反应。所以属于氧化还原反应的容器为C。(3)浓硝酸不稳定,光照容易分解,温度越高越容易分解,为防止浓硝酸的分解,常把浓硝酸保存在棕色玻璃瓶中,放在冷暗处。分解的方程式为4HNO3
4NO+6H2O;⑵在吸收塔C中通入空气的目的是为了将一氧化氮氧化成二氧化氮;在C中发生反应:2NO+O2=2NO2;3NO2+ H2O == 2HNO3+ NO。在D中发生反应:HNO3+NH3=NH4NO3.前两个反应是氧化还原反应,第三个不是氧化还原反应。所以属于氧化还原反应的容器为C。(3)浓硝酸不稳定,光照容易分解,温度越高越容易分解,为防止浓硝酸的分解,常把浓硝酸保存在棕色玻璃瓶中,放在冷暗处。分解的方程式为4HNO3 4NO2↑+O2↑+2H2O 。⑷硝酸有强氧化性,不仅能把活泼的金属氧化,还能把不活泼的金属如Cu氧化。金属铜与稀硝酸反应化学方程式为:3Cu+8HNO3(稀)=2Cu(NO3)2+2NO↑+4H2O 其离子方程式是3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。在该反应中一部分硝酸中的N由+5价变为+2价,得到电子,被还原,表现氧化性,还有一部分化合价没有变化,提供酸根离子用来形成硝酸盐,起酸的作用。故硝酸的作用是酸性和氧化性。
4NO2↑+O2↑+2H2O 。⑷硝酸有强氧化性,不仅能把活泼的金属氧化,还能把不活泼的金属如Cu氧化。金属铜与稀硝酸反应化学方程式为:3Cu+8HNO3(稀)=2Cu(NO3)2+2NO↑+4H2O 其离子方程式是3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。在该反应中一部分硝酸中的N由+5价变为+2价,得到电子,被还原,表现氧化性,还有一部分化合价没有变化,提供酸根离子用来形成硝酸盐,起酸的作用。故硝酸的作用是酸性和氧化性。
