(1)某兴趣小组在实验室探究工业合成硝酸的化学原理。
①氨的催化氧化:图a是探究氨的催化氧化的简易装置,实验中观察到锥形瓶中铂丝保持红热,有红棕色气体生成或白烟产生。白烟的成分是 (填化学式)。
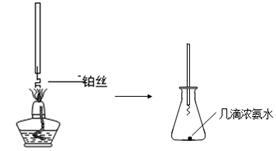
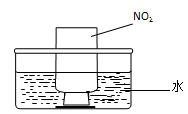
图a 图b
②NO2的吸收:如图b所示,将一瓶NO2倒置于水槽中,在水下移开玻璃片,可观察到的现象是 。
(2)三价铁盐溶液因Fe3+水解而显棕黄色,请以Fe(NO3)3溶液为例,设计实验探究影响盐类水解程度的因素。
①写出Fe(NO3)3水解的离子方程式 。
②参照示例完成下表实验方案的设计。
限选材料:0.05mol•L-1Fe(NO3)3、0.5mol•L-1Fe(NO3)3、1.0mol•L-1HNO3、1.0mol•L-1NaOH、NaHCO3固体、蒸馏水、冰水混合物;pH计及其他常见仪器。
| 可能影响因素 | 实验操作 | 预期现象和结论 |
| 溶液的酸碱性 | 取少量0.5mol•L-1Fe(NO3)3于试管中,加入几滴1mol•L-1HNO3。 | 棕黄色溶液颜色变浅,说明溶液酸性增强能抑制Fe(NO3)3的水解。 |
| 盐的浓度 |
|
|
|
|
|
(1)(共4分)① NH4NO3 (2分)
② 集气瓶中红棕色逐渐消失,集气瓶中的液面逐渐上升 (2分)
(2)(共12分)
① Fe3+ + 3H2O  Fe(OH)3 + 3H+ (2分)
Fe(OH)3 + 3H+ (2分)
②(注:合理的表达或方案也给分,每空2分,共10分)
| 影响条件 | 实验操作 | 预期现象和结论 |
| ②盐的浓度 | 用量筒取10mL Fe(NO3)3于烧杯中,用pH计测出pH值.另取90mL蒸馏水加入烧杯,充分搅拌,再用pH计测出pH值。 | 前后测得pH值之差小于1。说明加水稀释后平衡右移,生成更多的H+,故增大Fe(NO3)3浓度,抑制Fe(NO3)3水解。 |
| 或②盐的浓度 | 用pH计分别测定0.05mol•L-1Fe(NO3)3和0.5mol•L-1Fe(NO3)3的pH,并比较大小。 | 二种溶液的pH值之差小于1。说明增大c(Fe(NO3)3),抑制Fe(NO3)3水解。 |
| 或②盐的浓度 | 取少量0.5mol•L-1Fe(NO3)3于试管中加入少量NaHCO3固体。 | 溶液颜色变深。说明加入少量NaHCO3固体可减少c(H+)促进Fe(NO3)3水解。 |
| 或②盐的浓度 | 取少量0.5mol•L-1Fe(NO3)3于试管中加入几滴1.0mol•L-1NaOH | 产生红棕色沉淀,棕黄色溶液变成无色,说明加入NaOH可减少c(H+)能促进Fe(NO3)3水解。 |
| ③升高温度 | 取少量0.5mol•L-1Fe(NO3)3于试管中,再用酒精灯加热一段时间,观察溶液颜色 | 加热后溶液颜色变深。说明升高温度促进Fe(NO3)3水解。 |
| 或③降低温度 | 取少量0.5mol•L-1Fe(NO3)3于试管中,再将试管置于放有冰水混合物的烧杯中一段时间,观察溶液颜色 | 棕黄色溶液颜色变浅。说明降低温度能抑制Fe(NO3)3水解。 |
题目分析:(1)①氨与氧气发生催化氧化,生成NO和水,NO与空气中的氧气反应生成红棕色气体二氧化氮,二氧化氮与水反应又有硝酸生成,硝酸与氨气反应生成白色固体硝酸铵,则白烟的成分是NH4NO3;
②二氧化氮溶于水,生成硝酸和无色气体NO,同时瓶内压强减小,所以看到集气瓶内红棕色气体消失,集气瓶中的液面逐渐上升;
(2)①Fe(NO3)3水解生成氢氧化铁和硝酸,离子方程式为Fe3+ + 3H2O  Fe(OH)3 + 3H+
Fe(OH)3 + 3H+
②影响盐水解程度的因素有浓度、温度。根据铁离子水解的离子方程式判断增大铁离子浓度平衡正向移动,可采用不同浓度的Fe(NO3)3溶液,进行实验,测定溶液的pH,判断水解程度的大小;增大H+ 浓度平衡逆向移动,溶液棕黄色变浅;水解反应可看成是中和反应的逆反应,所以是吸热反应,升高温度平衡,正向移动,溶液棕黄色加深。具体实验如下表:
| 影响条件 | 实验操作 | 预期现象和结论 |
| ②盐的浓度 | 用量筒取10mL Fe(NO3)3于烧杯中,用pH计测出pH值.另取90mL蒸馏水加入烧杯,充分搅拌,再用pH计测出pH值。 | 前后测得pH值之差小于1。说明加水稀释后平衡右移,生成更多的H+,故增大Fe(NO3)3浓度,抑制Fe(NO3)3水解。 |
| 或②盐的浓度 | 用pH计分别测定0.05mol•L-1Fe(NO3)3和0.5mol•L-1Fe(NO3)3的pH,并比较大小。 | 二种溶液的pH值之差小于1。说明增大c(Fe(NO3)3),抑制Fe(NO3)3水解。 |
| 或②盐的浓度 | 取少量0.5mol•L-1Fe(NO3)3于试管中加入少量NaHCO3固体。 | 溶液颜色变深。说明加入少量NaHCO3固体可减少c(H+)促进Fe(NO3)3水解。 |
| 或②盐的浓度 | 取少量0.5mol•L-1Fe(NO3)3于试管中加入几滴1.0mol•L-1NaOH | 产生红棕色沉淀,棕黄色溶液变成无色,说明加入NaOH可减少c(H+)能促进Fe(NO3)3水解。 |
| ③升高温度 | 取少量0.5mol•L-1Fe(NO3)3于试管中,再用酒精灯加热一段时间,观察溶液颜色 | 加热后溶液颜色变深。说明升高温度促进Fe(NO3)3水解。 |
| 或③降低温度 | 取少量0.5mol•L-1Fe(NO3)3于试管中,再将试管置于放有冰水混合物的烧杯中一段时间,观察溶液颜色 | 棕黄色溶液颜色变浅。说明降低温度能抑制Fe(NO3)3水解。 |
