问题
问答题
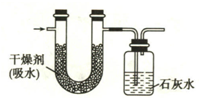
已知某气态燃料质量为1.6g,将其放入足量氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如下实验结果(假设生成的气体完全被吸收):
| 实验前 | 实验后 | |
| 干燥剂+U形瓶 | 202.2g | 205.8g |
| 石灰水+广口瓶 | 624.0g | 628.4g |
(2)若该气态燃料的相对分子质量为16,求其化学式.
答案
(1)由题意知,Ⅰ装置是用来吸收水的,Ⅱ装置是用来吸收二氧化碳的,实验中生成水的质量为205.8g-202.2g=3.6g;生成CO2的质量=628.4g-624.0g=4.4g.
根据质量守恒定律,该燃料中氢元素质量为:3.6g×
×100%=0.4g,碳元素的质量为:4.4g×2 18
×100%=1.2g,由于0.4g+1.2g=1.6g,故该燃料不含氧元素,只含有碳、氢元素;12 44
(2)该燃料中碳元素与氢元素的质量比为:1.2g:0.4g=3:1;则碳原子与氢原子的个数比为
:3 12
=1:4,因为该气态燃料的相对分子质量为16,所以化学式为CH4.1 1
答:(1)该气态燃料含碳、氢元素;质量分别为1.2克,0.4克;
(2)该气态燃料的化学式为CH4.
