某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
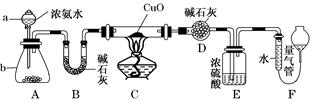
(1)仪器a的名称为________;仪器b中可选择的试剂为________。
(2)实验室中,利用装置A还可制取的无色气体是________(填字母)
A.Cl2
B.O2
C.CO2
D.NO2(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有________性,写出相应的化学方程式___________________________
________________________________________________________________________。
(4)E装置中浓硫酸的作用______________________________________________。
(5)读取气体体积前,应对装置F进行的操作:_______________________________________________________________。
(6)实验完毕,若测得干燥管D增重m g,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为________(用含m、n字母的代数式表示)
(1)分液漏斗 氧化钙或氢氧化钠固体或碱石灰
(2)BC
(3)还原 3CuO+2NH3 3Cu+3H2O+N2
3Cu+3H2O+N2
(4)吸收未反应的氨气,阻止F中水蒸气进入D
(5)慢慢上下移动右边漏斗,使左右两管液面相平
(6)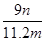
(1)仪器a为分液漏斗;氧化钙或氢氧化钠或碱石灰溶于水时都放出热量使NH3·H2O分解,所以b中可选择的试剂为氧化钙或氢氧化钠固体或碱石灰。
(2)氯气和二氧化氮是有色气体,故排除AD,该装置适用于固液体混合不加热制取气体,可以制取氧气: 2H2O2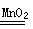 2H2O+O2↑,也制取二氧化碳:CaCO3+2HCl===CaCl2+CO2↑+H2O。
2H2O+O2↑,也制取二氧化碳:CaCO3+2HCl===CaCl2+CO2↑+H2O。
(3)该反应中氧化铜被还原生成单质铜,所以氨气有还原性,氨气和氧化铜反应生成铜、水和氮气,化学方程式为:3CuO+2NH3 3Cu+3H2O+N2。
3Cu+3H2O+N2。
(4)E装置中吸收未反应的氨气,阻止F装置中水蒸气进入D装置。
(5)读取量气管中气体的体积时,慢慢上下移动右边漏斗,使左右两管液面相平
(6)干燥管吸收的物质是水,量气管收集的气体是氮气,水的物质的量为m g/18 g·mol-1含有的氢原子为m/9 mol,氮气的物质的量为n L/22.4 L·mol-1,氮原子的物质的量为n/11.2 mol,则氨分子中氮、氢的原子个数比为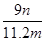 。
。
