某化学课外活动小组通过实验探究NO2的性质。已知:2NO2+2NaOH=NaNO3+NaNO2+H2O。
任务1:利用如图所示装置探究NO2能否被NH3还原(K1、K2均为止水夹,夹持装置已略去)。
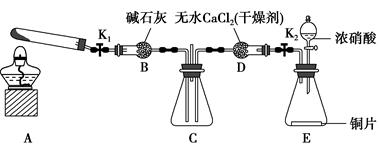
(1)E装置中制取NO2的化学反应方程式是____________________________
____________________________________________。
(2)若NO2能够被NH3还原,预期在C装置中观察到的现象是________________________________________________________________。
(3)实验过程中,未能观察到C装置中的预期现象。该小组同学从反应原理的角度分析了原因,认为有以下三种可能:
①NH3还原性较弱,不能将NO2还原;
②在此条件下,NO2的转化率极低;
③______________________________________________________________。
(4)此实验装置中一个明显的缺陷是__________________________________。
任务2:探究NO2能否与Na2O2发生氧化还原反应。
(5)实验前,该小组同学提出三种假设。
假设1:二者不反应;
假设2:NO2能被Na2O2氧化;
假设3:________________________________________________________。
(6)为了验证假设2,该小组同学选用任务1中的B、D、E装置,将B中的药品更换成Na2O2,另选F装置(如图所示),重新组装进行实验。
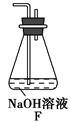
①装置的合理连接顺序是(某些装置可以重复使用)________。
②实验过程中,B装置中的粉末由淡黄色逐渐变成白色。经检验,该白色物质为纯净物,且无其他物质生成。推测B装置中发生反应的化学方程式为__________________________________
(1)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O (2)C装置中混合气体的颜色变浅 (3)在此条件下,该反应的化学反应速率极小 (4)缺少尾气吸收装置 (5)NO2能被Na2O2还原(其他合理答案也可)
(6)①EDBDF ②2NO2+Na2O2=2NaNO3
(1)E中浓硝酸与铜片发生反应生成NO2:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O。(2)装置A用于制备NH3,NH3被碱石灰干燥后进入装置C中,装置E中生成的NO2经无水CaCl2干燥后也进入装置C中,由于NO2具有氧化性,NH3具有还原性,若NO2能被NH3还原,则在装置C中发生的反应为6NO2+8NH3=7N2+12H2O,随着红棕色的NO2被消耗,装置C中混合气体的颜色逐渐变浅。(3)该同学是从反应原理探究NO2与NH3的反应,若在实验过程中,未能观察到C装置中的预期现象,需从二者是否能发生反应、能反应但NO2的转化率很低或者能反应但反应速率很小,短时间内NO2的消耗量很少,短时间内看不到明显的现象。(4)由于多余的NH3、NO2会从装置C中竖放的玻璃管中逸出,从而会对环境造成影响,所以该实验需在装置C中竖放的玻璃管处连接一个尾气处理装置。(5)根据价态分析,NO2中氮元素处于中间价态,既有氧化性,又有还原性,Na2O2中的O元素也是处于中间价态,也具有氧化性和还原性,所以假设3应该是NO2能被Na2O2还原(或NO2能氧化Na2O2)。(6)①选择E装置制备NO2,选择D装置干燥NO2,选择B装置盛放Na2O2,选择F装置进行尾气处理,为防止F装置中的少量水蒸气对反应产生干扰,最好在B、F装置之间再加装D装置,故装置连接顺序为E→D→B→D→F。②假设2是NO2能被Na2O2氧化,根据B装置中的实验现象“粉末由淡黄色逐渐变成白色”,说明Na2O2与NO2发生了反应,NO2为还原剂,分子中N元素的化合价升高至+5,反应产物又只有一种,推知为NaNO3,推测B装置中发生反应的化学方程式为2NO2+Na2O2=2NaNO3。
