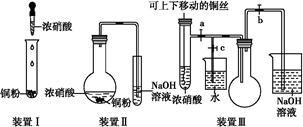
化学实验要符合“绿色化学”理念。某实验小组对“铜与浓硝酸反应”进行了探究性实验。试回答下列问题:
(1)写出铜和浓硝酸反应的离子方程式: 。
(2)与装置Ⅰ相比,装置Ⅱ的优点是 ,装置Ⅲ除具有装置Ⅱ的优点外,还有的优点是 。
(3)在装置Ⅲ中,若使NO2气体充满烧瓶,应先关闭弹簧夹 ,再打开弹簧夹 ;当气体充满烧瓶后,将铜丝提起,然后把a、b、c都关闭,并把烧瓶置于沸水中,下列情况不变的是 。
A.颜色
B.质量
C.气体的平均相对分子质量
D.密度E.压强
(4)为了验证NO2与水的反应,欲使烧杯中的水进入烧瓶的操作是 。
(1)Cu+4H++2N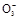
 Cu2++2NO2↑+2H2O
Cu2++2NO2↑+2H2O
(2)无氮的氧化物逸出,避免了对空气的污染 可控制反应随时进行,随时停止
(3)c ab BD
(4)关闭a和c,打开b,继续对烧瓶水浴加热,待气体不再放出时关闭b,停止加热,打开c
(2)比较三种装置的结构,结合本实验原理,装置Ⅱ比装置Ⅰ优越的地方有:无氮的氧化物逸出,避免了对空气的污染;装置Ⅲ的优点还有:可控制反应随时进行,随时停止。
(3)若要让NO2充满烧瓶,需要关闭开关c、打开a和b;由于在烧瓶中存在2NO2(g) N2O4(g) ΔH<0,在沸水中,平衡左移,颜色加深、气体平均相对分子质量减小,压强增大,但是混合气体的质量和密度不变。
N2O4(g) ΔH<0,在沸水中,平衡左移,颜色加深、气体平均相对分子质量减小,压强增大,但是混合气体的质量和密度不变。
(4)若要让烧杯中的水进入烧瓶,则应减小烧瓶内的气压,所以可采取措施:关闭a和c,打开b,对烧瓶水浴
加热,则一部分NO2气体进入NaOH溶液进行反应,再降温,则烧瓶中气压会减小,此时打开c,关闭b,水即进入烧瓶。
