氨气在工农业生产中有重要的用途。某校甲、乙两个化学小组分别对氨的相关实验进行了研究。

(1)甲、乙两小组选择了不同方法制取氨气,
请将实验装置的字母编号和制备原理填写在下表空格中。
| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙、氯化铵 | 反应的化学方程式为 ① |
| 乙小组 | ② | 浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: ③ |
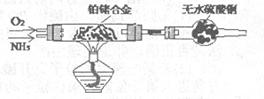
(2)甲组通过右图装置(尾气处理装置已略去)验证了氨有还原性,装置中的实验现象是____ ,硬质玻璃管中氨发生催化氧化反应的化学方程式为 。
(3)甲组将足量氨气不断通入滴有酚酞的AgNO3溶液中,现象为 ,
反应结束所得溶液中除了H+、OH-、NH4+外还主要含有的离子有 。
(4)乙组欲制备氮化镁,查阅资料发现氨跟氧化铜反应可以制备氮气(2NH3+3CuO 3Cu+N2+3H2O),而氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水立即反应生成Mg(OH)2和NH3。乙组提出了如下制备氮化镁的实验方案示意框图(实验前系统内空气已排除;图中箭头表示气体的流向)。你认为此方案是否正确,并说明理由 。
3Cu+N2+3H2O),而氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水立即反应生成Mg(OH)2和NH3。乙组提出了如下制备氮化镁的实验方案示意框图(实验前系统内空气已排除;图中箭头表示气体的流向)。你认为此方案是否正确,并说明理由 。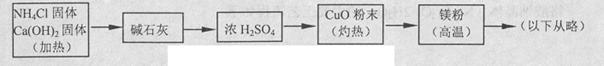
(1)① 2NH4Cl+Ca(OH)2 CaCl2+2H2O+2NH3↑。(2分)②B (1分)
CaCl2+2H2O+2NH3↑。(2分)②B (1分)
③固体NaOH溶于浓氨水后,放出大量的热,促使NH3的挥发;溶液中OH-浓度的增加,使NH3+H2O NH3·H2O
NH3·H2O NH4+ +OH-向生成NH3的方向移动。(2分)
NH4+ +OH-向生成NH3的方向移动。(2分)
(2)玻璃管中出现红棕色,干燥管中固体变蓝(2分) (2分)
(2分)
(3)先产生白色沉淀,后消失;溶液最后变成红色(2分)Ag(NH3)2+、NO3- (2分)
(4)方案错误;反应产生的NH3全部被H2SO4吸收,不能进行后续反应。(2分)
题目分析:(1)①氢氧化钙、氯化铵制取氨气的化学方程式为2NH4Cl+Ca(OH)2 CaCl2+2H2O+2NH3↑
CaCl2+2H2O+2NH3↑
②浓氨水、氢氧化钠制取氨气应选择B装置,
③氨水中存在NH3+H2O NH3·H2O
NH3·H2O NH4+ +OH-的平衡,加入NaOH固体,一是OH-浓度增大,平衡逆向移动;二是NaOH固体溶于水后放出大量的热,促使NH3的挥发;
NH4+ +OH-的平衡,加入NaOH固体,一是OH-浓度增大,平衡逆向移动;二是NaOH固体溶于水后放出大量的热,促使NH3的挥发;
(2)氨气与氧气在催化剂作用下生成一氧化氮气体,该气体遇空气变为红棕色二氧化氮;同时还有水生成,所以无水硫酸铜变蓝色;
(3)甲组将足量氨气不断通入滴有酚酞的AgNO3溶液中,氨气溶于水后,溶液显碱性,与Ag+反应生成氢氧化银沉淀,继续通氨气产生氢氧化二氨合银,沉淀溶解,最终溶液变红色;反应结束所得溶液中除了H+、OH-、NH4+外还主要含有的离子Ag(NH3)2+、NO3-
(4)不正确,反应产生的氨气全部被浓硫酸吸收,无法进行后面的反应
