(16分)亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛。以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示。

已知:室温下,① 2NO+Na2O2=2NaNO2;②酸性条件下,NO或NO2—都能与MnO4—反应生成NO3—和Mn2+,5NO2— + 2MnO4—+ 6H+=5NO3—+ 2Mn2++ 3H2O。
(1)A中观察到的现象__________________________。
(2)装置B中反应的离子方程式有____________________,_____________________。
(3)装置C的作用:____________________,装置F的作用:___________________。
(4)若无装置D,则E中产物除亚硝酸钠外还含有副产物________________________。(填化学式)
(5)NaNO2有像食盐一样的咸味,但能引起中毒。已知亚硝酸钠能发生如下反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O,根据上述反应,可以用试剂和生活中常见的物质进行实验,以鉴别亚硝酸钠和食盐。进行实验时,必须选用的物质有__________________。
A.自来水
B.碘化钾淀粉试液
C.淀粉
D.白糖 E.食醋 F.白酒(6)充分反应后,某同学设计实验对E中NaNO2的含量进行检测。称取E中固体2g,完全溶解配制成溶液100 ml,取出25 ml溶液用0.100 mol/L酸性KMnO4溶液进行滴定(杂质不与KMnO4反应),消耗KMnO4溶液20ml,求样品中亚硝酸钠的质量分数(保留小数点后1位)(已知:NaNO2摩尔质量69g/mol)
(1)有红棕色气体生成 (2分)
(2)3NO2+H2O=2H++2NO3-+NO↑(2分)3Cu+8H++2NO3—=3Cu2++2NO↑+4H2O (2分)
(3)防止倒吸(2分) 吸收未反应的NO(2分) (4)Na2CO3 NaOH (2分)
(5)BE (2分) (6)69.0% (2分)
题目分析:(1)根据装置图可知,A中浓硝酸与木炭发生氧化还原反应生成CO2和NO2以及水,因此A中观察到的现象有红棕色气体生成。
(2)NO2溶于水生成NO和硝酸,硝酸具有氧化性能把金属铜氧化,则装置B中反应的离子方程式有3NO2+H2O=2H++2NO3-+NO↑、3Cu+8H++2NO3—=3Cu2++2NO↑+4H2O。
(3)NO2极易溶于水与水反应,所以装置C的作用是防止倒吸;NO与过氧化钠反应后有剩余,随意排放容易引起大气污染,而NO能被酸性高锰酸钾溶液氧化,则装置F的作用吸收未反应的NO。
(4)生成的NO中含有CO2和水蒸气,二者均能与过氧化钠反应,而碱石灰可以吸收CO2和水蒸气,所以如果没有D装置,则E中产物除亚硝酸钠外还含有副产物Na2CO3、NaOH。
(5)KI与NaNO2反应生成I2必须在酸性条件下才能反应,食醋会电离出微量的氢离子,碘化钾在食醋本身带的溶剂水中电离出碘离子,亚硝酸钠电离出亚硝酸根与钠离子,发生反应生成碘单质,I2使湿润的淀粉碘化钾试纸变蓝,因此答案为BE。
(6)消耗高锰酸钾的物质的量是0.1mol/L×0.02L=0.002mol,则根据方程式5NO2— + 2MnO4—+ 6H+=5NO3—+ 2Mn2++ 3H2O可知,亚硝酸钠的物质的量是0.002mol×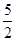 =0.005mol,则原样品中亚硝酸钠的物质的量是0.005mol×
=0.005mol,则原样品中亚硝酸钠的物质的量是0.005mol×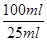 =0.02mol,其质量为0.02mol×69g/mol=1.38g,所以样品中亚硝酸钠的质量分数
=0.02mol,其质量为0.02mol×69g/mol=1.38g,所以样品中亚硝酸钠的质量分数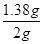 ×100%=69.0%。
×100%=69.0%。
