工业生产粗硅的主要原理为:SiO2+2C 3273K Si(粗)+2CO↑。
(1)若在制粗硅的过程中同时生成了碳化硅,且生成的硅和碳化硅的物质的量之比为5∶1,则参加反应的C和SiO2的质量比为 。
(2)工业上可通过如下流程由粗硅制取纯硅:
| ||||||
|
| |||||


 Si(粗) SiCl4(l) Si(纯)
Si(粗) SiCl4(l) Si(纯)
若上述反应中Si(粗)和SiCl4的利用率均为80%,制粗硅时有10%的SiO2转化为SiC,则生产100.8t纯硅需纯度为75%的石英砂多少吨?
(3)工业上还可以通过下图所示的流程来制取纯硅:
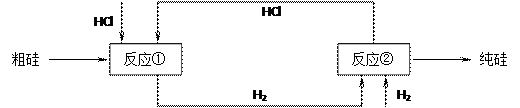
反应①: Si(粗)+3HCl(g) 553~573K SiHCl3(l)+H2(g)
反应②: SiHCl3+H2 1373K Si(纯)+3HCl
假设在每一轮次的投料生产中,硅元素没有损失,反应①中HCl的利用率为75%,反应②中H2的利用率为80%,则在下轮次的生产中,需补充投入HCl和H2的体积比为多少?
(1)① SiO2+2C 3273K Si(粗)+2CO↑ ② Si+ C="SiC" 若①×6+ ②得
6SiO2+13C 3273K 5Si(粗)+SiC+ 12CO↑ ,此时两者质量比为(12×13):(60×6)=13:30
(2)设需纯度为75%的石英砂x。
根据题意有下列关系式:
SiO2 ~ Si ~ SiCl4 ~ Si(纯)
60 28
x×75%×(1-10%)×80%×80% 100.8t (2分)
解得:x="500t " (2分)
(3)设每轮生产投入的粗硅中含1molSi
则由反应①可知:
消耗HCl的物质的量为3 mol /75%=4mol,生成H2的物质的量为1mol(1分)
由反应②可知:
消耗H2的物质的量为1mol/80%=1.25mol,生成HCl的物质的量为3mol (1分)
则在一轮次的生产中,需补充投入HCl和H2的物质的量之比(即体积比)为:
(4mol-3mol)∶(1.25mol-1mol)=4∶1(1分)
(1)① SiO2+2C 3273K Si(粗)+2CO↑ ② Si+ C="SiC" 若①×6+ ②得
6SiO2+13C 3273K 5Si(粗)+SiC+ 12CO↑ ,此时两者质量比为(12×13):(60×6)=13:30
(2)设需纯度为75%的石英砂x。
根据题意有下列关系式:
SiO2 ~ Si ~ SiCl4 ~ Si(纯)
60 28
x×75%×(1-10%)×80%×80% 100.8t (2分)
解得:x="500t " (2分)
(3)设每轮生产投入的粗硅中含1molSi
则由反应①可知:
消耗HCl的物质的量为3 mol /75%=4mol,生成H2的物质的量为1mol(1分)
由反应②可知:
消耗H2的物质的量为1mol/80%=1.25mol,生成HCl的物质的量为3mol (1分)
则在一轮次的生产中,需补充投入HCl和H2的物质的量之比(即体积比)为:
(4mol-3mol)∶(1.25mol-1mol)=4∶1(1分)
