已知A、B、C、D、E是中学化学中常见的五种化合物,它们分别由短周期两种元素组成,甲、乙、丙是单质,常温下甲、丙、A、C、D、E是气体,B为液体,乙为固体,①③必须在高温下反应才能发生。这些单质和化合物之间存在如下关系:
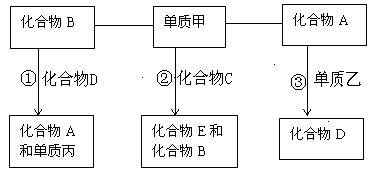
(1)写出甲的分子式 ; A的结构式 ;B的电子式 。
(2)若反应②是重要的工业反应,则该反应的化学方程式为 。
若反应②生成的化合物E具有漂白性,则该反应的化学方程式为 。
(3)1mol单质乙和1mol化合物B在高温下反应,生成1mol化合物D和1mol单质丙需吸收131.5kJ热
量,写出其反应的热化学方程式: 。
(4)在密闭容器中,反应①是在高温下才能发生的可逆反应,其化学反应方程式为:
;反应达平衡后,若增大体系的压强,该平衡 (填向左移动,向右移动,不移动);其理由是: 。
(1)甲为 O2 A结构式:O=C=O B电子式: (每空1分,共3分)
(每空1分,共3分)
(2)
 (3分)
(3分)
 (3分)
(3分)
(3)
 (3分)
(3分)
(4)
 ;(3分)
;(3分)
不移动;(1分)高温下化合物B为气体,反应前后气体的总体积不变。(2分)
此题的关键在于寻找突破口,明显的突破口有化合物B常温为液体,所以B为水。隐蔽突破口有①③必须在高温下反应才能发生,所以化合物B变为水蒸气,又知乙为固体,化合物A、化合D均为气体。据反应化合物A(气)+ 单质乙(固)=化合物D(气);从而联想到变价非金属,所以单质乙为碳单质、A为CO2、D为CO;再由H2O(气)+ 化合物D(气)=化合物A(气)+单质丙(气)推知单质丙为H2。
解这道题的另一关键,是冷静读完全题,从问题中寻找隐蔽突破口。读完问题(2)可知满足反应:
单质甲(气)+ 化合物C(气)="=" 化合物E+H2O,且 C、E分别由短周期两种元素组成;在根据若②是重要的工业反应;可推知符合此条件的只有氨的催化氧化;所以甲为O2,C为NH3,E为NO;若②生成的化合物E具有漂白性,E又是由短周期两种元素组成,可联想到E为SO2;所以C为H2S。则此题便可迎刃而解。
