(选做题)
按下列要求填空:
(1)将2.8gFe加入稀盐酸中,铁完全反应,在标准状况下,生成H2的体积为______L.
(2)实验室需配制480mL1mol/LNa2CO3溶液,需要称量Na2CO3的质量是______g(精确到0.1g).
(3)有O2与HCl组成的混合气体,其质量比是32:73,则O2与HCl的体积比是______.
(4)相同质量的S02和S03中,所含原子个数比是______.
(5)与标准状况下VLCO2所含氧原子数目相同的水的质量是______g.(用最简分式表示)
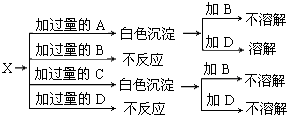
(6)A、B、C、D分别是NaNO3、NaOH、HNO3和Ba(NO3)2四种溶液中的一种,现利用另一种溶液X,用如图所示的方法可将它们依次确定.
试确定A、B、C、D、X各代表何种溶液.
A:______,B:______,C:______,D:______,X:______.
(1)2.8gFe的物质的量为
=0.05mo,发生反应Fe+2HCl=FeCl2+H2↑,由方程式可知,生成氢气的物质的量为0.05mol,故生成氢气的体积为0.05mol×22.4L/mol=1.12L,故答案为:1.12;2.8g 56g/mol
(2)实验室没有480mL的容量瓶,选择500mL容量瓶,配制500mL1mol/LNa2CO3溶液,碳酸钠的物质的量为0.5L×1mol/L=0.5mol,故需要碳酸钠的质量为0.5mol×106g/mol=53.0g,故答案为:53.0;
(3)质量比是32:73的O2与HCl的物质的量之比为
:32 32
=1:2,相同条件下体积之比等于物质的量之比为1:2,故答案为:1:2;73 36.5
(4)令质量为1g,S02的物质的量为
mol,S03的物质的量为1 64
mol,故相同质量的S02和S03中所含原子个数比为:1 80
mol×3:1 64
mol:4=15:16,故答案为:15:16;1 80
(5)标准状况下VLCO2的物质的量为
=VL 22.4L/mol
mol,氧原子的物质的量等于二氧化碳的2倍,氧原子物质的量为V 22.4
mol×2=V 22.4
mol,含有相等氧原子的水的物质的量为V 11.2
mol,故水的质量为V 11.2
mol×18g/mol=V 11.2
g,故答案为:45V 28
;45V 28
(6)因为NaNO3、HNO3不能与其他物质反应生成沉淀,故X与NaOH和Ba(NO3)2反应生成白色沉淀,实质就是X中的金属离子和氢氧根能结合成白色沉淀,X中的酸根离子和钡离子结合成沉淀,故X应该是MgSO4,生成的白色沉淀是氢氧化镁和硫酸钡,氢氧化镁溶于硝酸,硫酸钡不溶于硝酸,由此可推断则A是NaOH,B是NaNO3,C是Ba(NO3)2,D是HNO3,X是MgSO4,
故答案为:NaOH;NaNO3;Ba(NO3)2;HNO3;MgSO4.
