有三种透明且不溶于水的坚硬固体,A固体在氧气中完全燃烧只能得到一种无色气体,此气体能使澄清石灰水变浑浊,标准状况时测得此气体密度为氧气密度的1.375倍。B固体能溶于苛性钠溶液,再往该溶液中加入过量盐酸时,析出白色胶状沉淀,此沉淀干燥后,得到不溶于水的白色粉末,它是一种比碳酸还弱的酸。将B与石灰石、纯碱按比例混合加热后,能得到C,C在高温时软化,无固定熔点。
根据上述事实,判断A、B、C各为何物。
A ;B ;C 。
写出有关反应的化学方程式 。
金刚石 石英 普通玻璃
C+O2 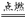 CO2
CO2
CO2+Ca(OH)2  CaCO3↓+H2O
CaCO3↓+H2O
SiO2+2NaOH  Na2SiO3+H2O
Na2SiO3+H2O
Na2SiO3+2HCl+H2O  H4SiO4↓+2NaCl
H4SiO4↓+2NaCl
H4SiO4  H2SiO3+H2O
H2SiO3+H2O
CaCO3+Na2CO3+6SiO2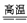 Na2O·CaO·6SiO2+2CO2↑(分两个方程式写也可以)
Na2O·CaO·6SiO2+2CO2↑(分两个方程式写也可以)
固体A燃烧后生成的气体的相对分子质量为32×1.375=44,再结合该气体为无色且能使澄清石灰水变浑浊的性质,可推断此气体为CO2;又因为A为透明不溶于水的坚硬固体,可判断A为金刚石;物质B能与苛性钠溶液反应,且所得溶液与盐酸反应生成一种酸性比碳酸还弱的难溶于水的酸,可推断B为石英;C由石灰石、纯碱、B物质(石英)混合加热而得,结合高温时软化且无固定熔点,可推知C为普通玻璃。
