问题
计算题
有两瓶溶液,A溶液:1L 1mol·L-1的纯碱溶液;B溶液:1L 1.25mol·L-1的盐酸。试计算在下列两种情况下产生的CO2在标准状况下的体积各多少升?(忽略CO2溶解于水)
(1)将A逐滴加入到B中;
(2)将B逐滴加入到A中。
答案
(1)将A逐滴加入B中,生成CO2气体为14L(标准状况);(2)将B逐滴加入A中,生成CO2气体为5.6L(标准状况)。
A为1L1mol·L-1的Na2CO3溶液,n(Na2CO3)=1mol。
B为1L1.25mol·L-1的HCl溶液,n(HCl)=1.25mol。
(1)Na2CO3+2HCl  2NaCl+H2O+CO2↑
2NaCl+H2O+CO2↑
2mol 22.4L
1.25mol V(CO2)
则 2mol∶1.25mol=22.4L∶V(CO2)
V(CO2)=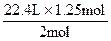 =14L
=14L
(2)Na2CO3+HCl  NaHCO3+NaCl ①
NaHCO3+NaCl ①
NaHCO3+HCl  NaCl+H2O+CO2↑ ②
NaCl+H2O+CO2↑ ②
由反应①消耗HCl 1mol;生成NaHCO3 1mol,还余HCl为0.25mol;而反应②消耗0.25mol HCl应生成0.25molCO2。
V(CO2)=22.4mol·L-1×0.25mol=5.6L
