A、B、C、D、E均为可溶于水的固体,它们的离子可能有:Na+、Ca2+、Ba2+、C1O-、HSO4-、CO32-、C1-.
分别取他们的溶液进行实验,主要操作及现象如下:
①向A的溶液中通入二氧化碳,再加入品红溶液,红色褪去.
②将B和C的溶液混合,生成白色沉淀,该沉淀可溶于E溶液.
③将B和D的溶液混合,生成白色沉淀,继续加入过量的E溶液,有气泡产生的同时还有白色沉淀存在.
④A和E溶液的焰色反应都呈黄色.
(1)写出下列物质的化学式:A______、B______、C______、E______.
(2)写出E溶液与铝发生反应的实验现象为______.
(3)向B的溶液中,缓慢滴入少量稀的E溶液后,其主要的溶质成分为______.(填化学式)
(4)D在空气中长期久置会失效.其化学方程式为______.
(1)根据题意,操作①中使品红溶液红色褪去的物质是具有强氧化性的HClO,可推得A中含有C1O-,反应为:
2C1O-+CO2+H2O═CO32-+2HClO,HClO利用自身强氧化性把品红氧化成稳定无色物质而褪色.
操作②中将B和C的溶液混合,生成白色沉淀,根据已知信息,白色沉淀为CaCO3或BaCO3,而该沉淀可溶于E溶液,说明E溶液为酸性溶液,即E溶液含HSO4-.如果白色沉淀为CaCO3,则反应为CaCO3+2H+═Ca2++CO2↑+H2O,如果白色沉淀为BaCO3,则反应为BaCO3+2H++SO42-═BaSO4↓+CO2↑+H2O,而该沉淀可溶于E溶液,因此该沉淀为CaCO3.
操作③中将B和D的溶液混合,生成白色沉淀,继续加入过量的E溶液,有气泡产生的同时还有白色沉淀存在,联系操作②中可得出B和D的溶液混合生成白色沉淀为BaCO3,加入过量的E溶液后,白色沉淀转变为BaSO4,则B中含CO32-、D中含Ba2+、C中含Ca2+.由于CaCO3或BaCO3都难溶于水,因此B为Na2CO3;Ca2+可与C1O-或C1-,因此C为CaC12或Ca(C1O)2;
操作④中A和E溶液的焰色反应都呈黄色,说明A和E都含Na+.则A为NaClO、E为NaHSO4.
故答案为:NaC1O;Na2CO3;CaC12或Ca(C1O)2;NaHSO4;
(2)E为NaHSO4,在水溶液中电离:NaHSO4═Na++H++SO42-,H+可与铝发生反应:6H++2Al═2Al3++H2↑,故观察到现象为有气体产生.
故答案为:有气体产生;
(3)B溶液为Na2CO3溶液,E溶液为NaHSO4溶液,向B的溶液中缓慢滴入少量稀的E溶液,发生反应:
Na2CO3+NaHSO4═NaHCO3+Na2SO4,故主要的溶质成分为NaHCO3或Na2SO4.
故答案为:Na2SO4或NaHCO3;
(4)D中含Ba2+,在空气中长期久置会失效,说明D不稳定,可确定D为Ba(ClO)2.易和空气中的二氧化碳与水发生反应,生成氯化钡和次氯酸,次氯酸再见光分解导致失效.方程式为:Ba(ClO)2+CO2+H2O═BaCl2+2HClO、2HClO
2HCl+O2↑. 光 .
故答案为:Ba(ClO)2+CO2+H2O═BaCl2+2HClO、2HClO
2HCl+O2↑. 光 .

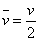 (式中
(式中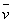 表示平均速度);而②
表示平均速度);而②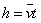 ,如果③v=kh成立的话,那么,必有h=
,如果③v=kh成立的话,那么,必有h=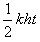 ,即
,即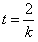 为常数。t是与h无关的常数!这显然与常识相矛盾!于是,可以排除速度v是随着下落高度h均匀变化的可能性。关于伽利略的这个理想推导,你认为[ ]
为常数。t是与h无关的常数!这显然与常识相矛盾!于是,可以排除速度v是随着下落高度h均匀变化的可能性。关于伽利略的这个理想推导,你认为[ ]