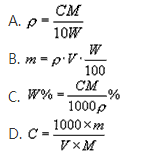硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.某课外小组测定该补血剂中铁元素的含量.实验步骤如下:
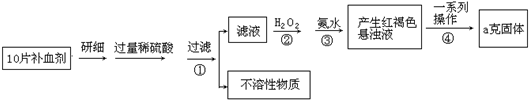
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是______.
(2)写出②中的离子反应方程式:______.
(3)步骤③中反应的离子方程式:______.
(4)步骤④中一系列处理的操作步骤:过滤、______、灼烧、冷却、称量.
(5)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定.(5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除药匙、天平(附砝码)、玻棒、烧杯、胶头滴管外,还需______.
②滴定到终点时的颜色为______色.
(6)正常人每天应补充16.8mg左右的铁.其中绝大部分来自于食物.如果全部通过服用含FeSO4•7H2O的片剂.来补充铁,则正常人每天服需用含______mgFeSO4•7H2O片剂.
(1)Fe3+遇KSCN溶液显红色,该现象用于检验Fe3+存在,可以加入氧化剂将Fe2+氧化为Fe3+,检验Fe2+可以先滴加KSCN溶液,溶液不变色,再滴加氯水或双氧水,溶液变为血红色,说明含有Fe2+.
故答案为:取少量滤液加入试管中,先滴加KSCN溶液,溶液不变色,再滴加氯水(或双氧水、稀硝酸),溶液变为血红色.
(2)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,同时生成水,反应离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O.
故答案为:2Fe2++H2O2+2H+═2Fe3++2H2O.
(3)步骤③是将Fe3+转化为氢氧化铁沉淀,反应离子方程式为Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+.
故答案为:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+.
(4)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,
故答案为:洗涤;冷却;
(5)①精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管,250mL容量瓶;
故答案为:250mL容量瓶;
②高锰酸钾为紫色,当滴定到终点时,Fe2+被完全氧化,加入的最后一滴高锰酸钾不反应,溶液的颜色为紫色,故答案为:紫.
(6)16.8mg铁即为FeSO4•7H2O片剂中铁的质量,所以需要FeSO4•7H2O片剂质量为16.8mg÷
=83.4mg.56 278
故答案为:83.4mg.

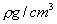 的溶液V mL,含有式量为M的溶质的质量为mg,其物质的量浓度为C mol/L,质量分数为W%,下列表示式不正确的是( )
的溶液V mL,含有式量为M的溶质的质量为mg,其物质的量浓度为C mol/L,质量分数为W%,下列表示式不正确的是( )