某学习小组对炭粉与氧化铁反应产物中气体的成分进行研究。
(1)提出假设:该反应的气体产物全部是二氧化碳(CO2)。
(2)设计方案:将一定量的氧化铁与炭粉的混合物在隔绝氧气的条件下完全反应(如下图),测定参加反应的碳元素与氧元素的质量比。
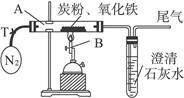
实验装置
(3)查阅资料:N2不与炭粉以及氧化铁发生反应,可用于隔绝氧气进行反应。
(4)实验操作:
①称取5.2 g氧化铁与炭粉的混合粉末,放入48.48 g的玻璃管中,按上图连接后必不可少的实验操作为___________________________________________________。
②加热前,先通一段时间纯净、干燥的氮气,其目的是_____________________________。
③夹紧T处弹簧夹,加热一段时间,澄清石灰水变浑浊,该现象说明_____________________。
④完全反应后,冷却至室温,称得玻璃管和固体的总质量为52.24克。
(5)数据处理:经计算,参加反应的碳元素质量为0.48克,氧元素质量为0.96克。
(6)得出结论:根据数据处理结果,反应生成的气体为CO和CO2,而且同条件下体积比为1∶1,原假设不成立,理由为__________________________________________________。
(7)该实验反应的化学方程式为_________________________________________________。
(4)①检查装置气密性 ②排尽装置中的空气(或氧气) ③有二氧化碳气体生成
(6)C、O质量比为0.48∶0.96=1∶2,与二氧化碳中C和O质量比3∶8不符
(7)2C+Fe2O3 2Fe+CO↑+CO2↑
2Fe+CO↑+CO2↑
根据题意,本实验为一定量实验,其原理是将一定量Fe2O3和C的混合物在用N2隔绝氧气的条件下完全反应,测参加反应的C元素和O元素的质量比,判断反应产物是否全是CO2。因此反应装置必须气密性好。
参加反应的C元素质量为0.48 g,物质的量为0.04 mol,O元素的质量为0.96 g,物质的量为0.06 mol,生成的碳氧化物中C、O物质的量之比为2∶3,则 ,即CO、CO2的物质的量比为1∶1,因此原假设不成立。该实验反应的化学方程式为2C+Fe2O3
,即CO、CO2的物质的量比为1∶1,因此原假设不成立。该实验反应的化学方程式为2C+Fe2O3 2Fe+CO↑+CO2↑。
2Fe+CO↑+CO2↑。
