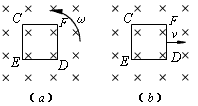问题
计算题
将一定量的碳与8 g O2置于一密闭容器中,使之在高温下反应,当恢复至原温度时,容器内压强比原来增大0.4倍,则参加反应的碳的质量是多少?
答案
4.2 g
同温同容时,气体的压强与气体的物质的量成正比。若只发生反应:
C+O2 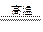 CO2
CO2
0.25 mol 0.25 mol
容器内压强不变,即增大0倍。
若只发生反应:
2C+O2 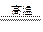 2CO
2CO
0.25 mol 0.5 mol
容器内压强增大1倍。
因为0<0.4<1,所以以上两个反应同时发生。
方法一:平行计算法
设转化为CO的碳的物质的量为x,转化为CO2的碳的物质的量为y,则:
2C+O2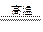 2CO
2CO
2 1 2
x 0.5x x
C+O2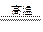 CO2
CO2
1 1 1
y y y
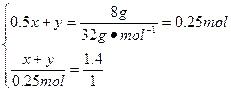
解得: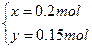
所以m(C)="(x+y)×12" g·mol-1="0.35×12" g="4.2" g
方法二:碳原子守恒法
据题意可知,碳的物质的量=混合气(CO和CO2)的物质的量=1.4倍O2的物质的量
即:n(C)=1.4×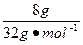 ="0.35" mol
="0.35" mol
m(C)="0.35" mol×12 g·mol-1="4.2" g