已知某待测液由Ag+、Fe2+、Al3+、K+、Ba2+、NH4+、NO3-、SO42-中的若干种离子组成,进行如下实验:
第一步:加入过量的稀盐酸,无沉淀生成.
第二步:继续加入过量的稀硫酸,有白色沉淀生成.
第三步:过滤,取少量滤液,滴入NaOH溶液至溶液呈碱性.
在此过程中溶液沉淀量的变化如图所示,加热该溶液,可产生使湿润的红色石蕊试纸变蓝色的气体.
根据以上实验现象回答下列问题:
(1)该待测液中一定含有______离子,一定没有______离子,可能有______离子.
(2)某同学采用测pH的方法来判断滴入NaOH溶液后是否使溶液呈碱性,该实验操作是______.
(3)第三步中产生使湿润红色石蕊试纸变蓝色的气体的离子方程式为______,该步骤中预期会出现另外一个特殊的实验现象,该现象对应的化学方程式为______.
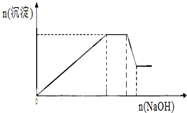
(1)加入过量的稀盐酸无沉淀生成,说明溶液中一定不存在与Cl-反应的Ag+;
继续加入过量的稀硫酸,有白色沉淀生成,白色沉淀为BaSO4,原溶液中一定存在Ba2+,则一定不存在与Ba2+反应的SO42-,根据溶液电中性可知,一定存在唯一的阴离子NO3-;
根据图象可知,加入NaOH溶液后沉淀逐渐增加,然后沉淀的量不变,最后有部分溶解,所以原溶液中一定存在Fe2+、Al3+、NH4+,加热溶液产生使湿润的红色石蕊试纸变蓝色的气体,该气体为氨气,说明溶液中一定存在NH4+,
根据以上分析可知,溶液中一定存在的离子为:Fe2+、Al3+、Ba2+、NH4+、NO3-;一定不存在的离子为:SO42-、Ag+;不能确定K+是否存在,
故答案为:Fe2+、Al3+、Ba2+、NH4+、NO3-;SO42-、Ag+;K+;
(2)所以pH试纸检测定溶液pH的方法为:取一片pH试纸置于表面皿上,用洁净的玻璃棒蘸取待测液,点在pH试纸的中部,与标准比色卡对照,判断溶液是否呈碱性,
故答案为:取一片pH试纸置于表面皿上,用洁净的玻璃棒蘸取待测液,点在pH试纸的中部,与标准比色卡对照,判断溶液是否呈碱性;
(3)使湿润红色石蕊试纸变蓝色的气体为氨气,该反应的离子方程式为:NH4++OH-
NH3↑+H2O;溶液中含有亚铁离子,亚铁离子与氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁在加热过程中被氧化成氢氧化铁,反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,△ .
故答案为:NH4++OH-
NH3↑+H2O;4Fe(OH)2+O2+2H2O=4Fe(OH)3.△ .

