有一无色溶液,其中可能含有Fe3+、Al3+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子中的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如图所示:

第③个实验中,生成白色沉淀的量与加入NaOH的量有如右图所示的相互关系.
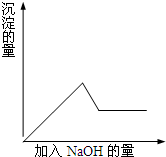
据此可知:(1)在原溶液中一定存在的离子有______;
(2)写出第③个实验中发生反应的离子方程式______;
(3)写出第④个实验中生成气体的化学方程式______.
(1)溶液透过蓝色钴玻璃焰色反应呈紫色,说明溶液中含有K+离子,溶液呈无色,则一定不含Fe3+离子,
逐滴加入过量NaOH溶液有白色沉淀,则溶液中含有Mg2+离子,
加入氯化钡和盐酸后生成白色沉淀,由于溶液中没有Ag+离子,则生成沉淀为BaSO4,溶液中含有SO42-离子,
第③个实验中,生成白色沉淀的量与加入NaOH的量的先增大后减小,则说明溶液中含有Al3+离子,
则原溶液中一定含有Al3+、Mg2+、K+、SO42-等离子,
故答案为:Al3+、Mg2+、K+、SO42-;
(2)溶液中含有Al3+、Mg2+,加入NaOH时先发生反应为,Mg2++2OH-=Mg(OH)2↓;Al3++3OH-=Al(OH)3↓,生成Mg(OH)2和Al(OH)3沉淀,当全部生成沉淀之后,再加入NaOH,氢氧化铝与NaOH继续反应,反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Mg2++2OH-=Mg(OH)2↓;Al3++3OH-=Al(OH)3↓;Al(OH)3+OH-=AlO2-+2H2O;
(3)过氧化钠与水反应生成NaOH和氧气,反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑,
故答案为:2Na2O2+2H2O=4NaOH+O2↑
