某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示:
回答下列问题:(已知:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-)
(1)原混合溶液中一定含有的离子是:______;
(2)AB段反应的离子方程式是:______;
(3)发生AB段反应的离子与发生BC段反应的物质两者物质的量之比为:______.
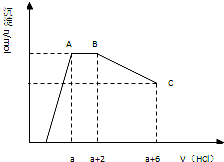
由图象可知,开始加入HCl时无沉淀生成,说明加入的HCl与溶液中OH-的反应,则溶液中一定不会存在与氢氧根离子发生反应的离子:Fe3+、Mg2+、Al3+;之后开始生成沉淀且反应生成沉淀逐渐增大,说明溶液中存在AlO2-、SiO32-,继续加入盐酸沉淀量不变,消耗盐酸的离子只能是CO32-离子,碳酸根离子反应完后继续加入盐酸,沉淀逐渐减小,到不再改变,进一步证明沉淀是氢氧化铝和硅酸沉淀,氢氧化铝沉淀溶于盐酸,最后剩余沉淀为硅酸;硫酸根离子不能确定存在,但根据溶液的电中性可知,溶液中至少含有K+、Na+离子中的一种离子,
(1)根据以上分析可知,原溶液中一定含有的离子是:OH-、SiO32-、AlO2-、CO32-,
故答案为:OH-、SiO32-、AlO2-、CO32-,;
(2)AB段碳酸根离子与盐酸发生反应,反应分步进行,反应的离子方程式为:CO32-+H+=HCO3-、HCO3-+H+=CO2↑+H2O,
故答案为:CO32-+H+=HCO3-、HCO3-+H+=CO2↑+H2O;
(3)依据图象可知和碳酸根离子反应的盐酸为2体积,反应总方程式为:CO32-+2H+=CO2↑+H2O;氢氧化铝溶解消耗的盐酸体积为4体积,反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O;所以原溶液中含有CO32-与Al(OH)3的物质的量之比为n(CO32-):n(Al(OH)3)=2×
:4×1 2
=3:4,1 3
故答案为:3:4.
