问题
问答题
[选做题]某固体氧化物X,经过①②两步反应后,得到红色固体单质C,溶液B只含一种溶质,且是盐,试回答:
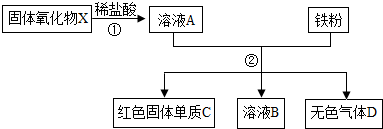
(1)第①步盐酸是否过量?判断根据是什么?______,______
(2)固体氧化物X的化学式是______.
(3)写出生成B的化学方程______.
答案
(1)铁粉与①加盐酸后所得的溶液A反应能生成无色气体,说明是铁与酸反应所得,所以①步盐酸过量,所以本题答案为:过量,第二步反应有无色气体生成,该气体由过量的盐酸与铁反应生成;
(2)固体氧化物与盐酸反应能生成金属氯化物,属于盐类物质,与铁反应生成了亮红色的固体单质C,该单质为铜,根据质量守恒定律说明原固体氧化物中含铜,故为氧化铜,所以本题答案为:CuO;
(3)分析可知,溶液A中含有盐酸和氯化铜,都可以与铁发生置换反应,所以本题答案为:Fe+CuCl2=Cu+FeCl2,
Fe+2HCl=H2↑+FeCl2.
