碳及其化合物有广泛的用途。
(1)在电化学中,常用碳作电极:
①在酸性锌锰干电池中,碳棒作 极。
②若用碳棒和铁棒做电极电解饱和食盐水生产烧碱时,碳棒作 极,反应的离子方程式 。
(2)将水蒸气通过红热的碳可产生水煤气:C(s)+H2O(g)  CO(g)+H2(g) △H=+131.3kJ/mol,达到平衡后,体积不变时,能提高H2O的平衡转化率的措施是 。
CO(g)+H2(g) △H=+131.3kJ/mol,达到平衡后,体积不变时,能提高H2O的平衡转化率的措施是 。
A.升高温度
B.增加碳的用量
C.加入催化剂
D.用CO吸收剂除去CO(3)将一定量的CO(g)和H2O(g)通过某恒容的密闭容器中,发生反应:CO(g)+H2O(g)  CO2(g)+H2(g)得到如下数据:
CO2(g)+H2(g)得到如下数据:
| 温度/℃ | 起始浓度mol/L | 平衡浓度mol/L | |
| CO(g) | H2O(g) | H2(g) | |
| 900 | 2.0 | 0.8 | 0.4 |
通过计算,该反应的平衡常数为: 。
(4)工业上把水煤气中的混合气体处理后,获得较纯的H2用于合成氨:
N2(g)+3H2(g)一定条件下2NH3(g) △H= —92.4kJ/mol某同学在不同实验条件下模拟化工生产进行实验,N2浓度随时间变化如图:
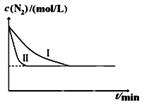
①与实验I比较,实验II改变的条件为: 。
②实验III比实验I的温度要高,其它条件相同,请在下图画出实验I和实验III中NH3浓度随时间变化的示意图。
(共16分)
(1) 正(1分);阳(1分);2Cl-+2H2O 2OH-+H2↑+Cl2↑(3分。写成化学方程式不给分;没配平、没写条件及没有气体上升符号总共扣1分,条件可以写“通电”);
2OH-+H2↑+Cl2↑(3分。写成化学方程式不给分;没配平、没写条件及没有气体上升符号总共扣1分,条件可以写“通电”);
(2)AD(4分。选1个对的得2分,全对4分);
(3)0.25或1/4(3分);
(4)①使用催化剂(2分)
②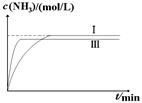 (2分,纵坐标起点可以大于0。Ⅲ比Ⅰ快1分,比Ⅰ少1分)
(2分,纵坐标起点可以大于0。Ⅲ比Ⅰ快1分,比Ⅰ少1分)
题目分析:(1)电化学基础,原电池和电解基本原理的考查,①锌锰酸性干电池中Zn做负极,石墨碳棒做正极,②氯碱工业原理——电解饱和食盐水时,石墨是惰性电极做阳极,铁做阴极,反应为:2Cl-+2H2O  2OH-+H2↑+Cl2↑;(2)A,该反应是吸热反应,升高温度平衡向正反应方向移动,CO转化率升高;B,碳是固体,增加用量转化率无影响,错误;C,催化剂不能使平衡移动,错误;D,降低生成物浓度,平衡向正反应方向移动,正确;(3)平衡常数计算:K=
2OH-+H2↑+Cl2↑;(2)A,该反应是吸热反应,升高温度平衡向正反应方向移动,CO转化率升高;B,碳是固体,增加用量转化率无影响,错误;C,催化剂不能使平衡移动,错误;D,降低生成物浓度,平衡向正反应方向移动,正确;(3)平衡常数计算:K=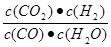 =
=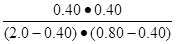 =0.25;(4)①识图可知II的转化率与I相同,但时间II更短,易得改变条件是使用催化剂;②作图要领:温度高反应速率快,平衡时间短,转化率低,注意拐点前置,但高度下降。
=0.25;(4)①识图可知II的转化率与I相同,但时间II更短,易得改变条件是使用催化剂;②作图要领:温度高反应速率快,平衡时间短,转化率低,注意拐点前置,但高度下降。
