问题
问答题
用双线桥分析下列氧化还原反应,并指出氧化剂还原剂
①Fe+2HCl=FeCl2+H2↑ 氧化剂______还原剂______
②MnO2+4HCl
MnCl2+Cl2↑+2H2O 氧化剂______还原剂______ △ .
③2Na+2H2O=2NaOH+H2↑ 氧化剂______还原剂______.
答案
①在反应Fe+2HCl=FeCl2+H2↑中,化合价降低元素是氢元素,所在的反应物HCl是氧化剂,化合价升高元素是铁元素,所在的反应物Fe是还原剂,化合价升高数=化合价降低数=转移电子数=2,故答案为:
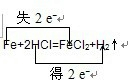
;氯化氢;铁;
②氧化还原反应根据氧化剂和还原剂可以分为:完全氧化还原反应和部分氧化还原反应,这是一个部分氧化还原反应,这里的还原剂氯化氢部分(50%)被氧化,化合价降低元素是Mn元素,所在的反应物二氧化锰是氧化剂,化合价升高元素是Cl元素,所在的反应物HCl是还原剂,化合价升高数=化合价降低数=转移电子数=2,故答案为:
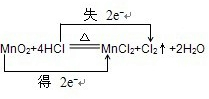
;二氧化锰;氯化氢;
③在反应2Na+2H2O=2NaOH+H2↑中,化合价降低元素是氢元素,所在的反应物水是氧化剂,化合价升高元素是钠元素,所在的反应物钠是还原剂,化合价升高数=化合价降低数=转移电子数=2,故答案为:
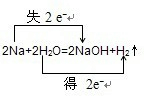
;水;钠.
